

醫(yī)療器械生產(chǎn)企業(yè)合規(guī)技術(shù)咨詢服務(wù)
注冊備案 · 臨床試驗 · 體系建立輔導(dǎo) · 分類界定 · 申請創(chuàng)新
186-0382-3910

第二類體外診斷試劑IVD注冊證(延續(xù)注冊)服務(wù)
如您的產(chǎn)品注冊證即將過期,企業(yè)仍想在證件到期后銷售該產(chǎn)品,您需要在二類醫(yī)療器械注冊證(體外診斷試劑)有效期屆滿6個月前向所在地省局注冊管理部門提出延續(xù)注冊申請。...
服務(wù)價:¥電議
好評系數(shù):

如您的產(chǎn)品注冊證即將過期,企業(yè)仍想在證件到期后銷售該產(chǎn)品,您需要在二類醫(yī)療器械注冊證(體外診斷試劑)有效期屆滿6個月前向所在地省局注冊管理部門提出延續(xù)注冊申請。
第二類體外診斷試劑產(chǎn)品范圍如下:
| 類別 | 產(chǎn)品范圍 | 分類注冊管理 |
|---|---|---|
| 第Ⅱ類產(chǎn)品 | 1、用于蛋白質(zhì)檢測的試劑; 2、用于糖類檢測的試劑; 3、用于激素檢測的試劑; 4、用于酶類檢測的試劑; 5、用于脂類檢測的試劑; 6、用于維生素檢測的試劑; 7、用于無機離子檢測的試劑; 8、用于藥物及藥物代謝物檢測的試劑; 9、用于自身抗體檢測的試劑; 10、用于微生物鑒別或藥敏試驗的試劑; 11、用于其他生理、生化或免疫功能指標(biāo)檢測的試劑; | 由省、自治區(qū)、直轄市藥品監(jiān)督管理部門審查,批準(zhǔn)后發(fā)給醫(yī)療器械注冊證書。 |
二類體外診斷試劑注冊證延續(xù)申報資料
1、申請表;
2、證明性文件:注冊人企業(yè)營業(yè)執(zhí)照的副本和組織機構(gòu)代碼證復(fù)印件;
3、關(guān)于產(chǎn)品沒有變化的聲明:注冊人提供產(chǎn)品沒有變化的聲明。(注冊證及其變更文件中載明的內(nèi)容、產(chǎn)品所涉及的相關(guān)國家標(biāo)準(zhǔn)和行業(yè)標(biāo)準(zhǔn)沒有修訂或沒有新的相關(guān)國家標(biāo)準(zhǔn)和行業(yè)標(biāo)準(zhǔn)發(fā)布、影響產(chǎn)品安全有效的設(shè)計、原材料、生產(chǎn)工藝、適用范圍、使用方法等)。
4、原醫(yī)療器械注冊證及其附件的復(fù)印件、歷次醫(yī)療器械注冊變更文件復(fù)印件;
5、注冊證有效期內(nèi)產(chǎn)品分析報告:
(1)產(chǎn)品臨床應(yīng)用情況,用戶投訴情況及采取的措施。
(2)醫(yī)療器械不良事件匯總分析評價報告,報告應(yīng)對醫(yī)療器械上市后發(fā)生的可疑不良事件列表、說明在每一種情況下生產(chǎn)企業(yè)采取的處理和解決方案。對上述不良事件進行分析評價,闡明不良事件發(fā)生的原因并對其安全性、有效性的影響予以說明。
(3)在所有上市國家和地區(qū)的產(chǎn)品市場情況說明。
(4)產(chǎn)品監(jiān)督抽驗情況(如有)。
(5)如上市后發(fā)生了召回,應(yīng)當(dāng)說明召回原因、過程和處理結(jié)果。
(6)原醫(yī)療器械注冊證中載明要求繼續(xù)完成工作的,應(yīng)當(dāng)提供相關(guān)總結(jié)報告,并附相應(yīng)資料。
6、產(chǎn)品檢驗報告:
如醫(yī)療器械強制性標(biāo)準(zhǔn)已經(jīng)修訂,應(yīng)提供產(chǎn)品能夠達到新要求的產(chǎn)品檢驗報告。產(chǎn)品檢驗報告可以是自檢報告、委托檢驗報告或符合強制性標(biāo)準(zhǔn)實施通知規(guī)定的檢驗報告。其中,委托檢驗告應(yīng)由具有醫(yī)療器械檢驗資質(zhì)的醫(yī)療器械檢驗機構(gòu)出具。
如有國家標(biāo)準(zhǔn)品、參考品發(fā)布或者更新的,應(yīng)提供產(chǎn)品能夠符合國家標(biāo)準(zhǔn)品、參考品要求的產(chǎn)品檢驗報告。產(chǎn)品檢驗報告可以是自檢報告、委托檢驗報告或符合相應(yīng)通知規(guī)定的檢驗報告。
7、符合性聲明:
(1)注冊人聲明本產(chǎn)品符合《體外診斷試劑注冊與備案管理辦法》和相關(guān)法規(guī)的要求;聲明本產(chǎn)品符合現(xiàn)行國家標(biāo)準(zhǔn)、行業(yè)標(biāo)準(zhǔn),并提供符合標(biāo)準(zhǔn)的清單。
(2)注冊人出具所提交資料真實性的自我保證聲明。
8、其他
(1)如在原注冊證有效期內(nèi)發(fā)生了涉及產(chǎn)品說明書和/或產(chǎn)品技術(shù)要求變更的,應(yīng)當(dāng)提交依據(jù)注冊變更文件修改的產(chǎn)品說明書和/或產(chǎn)品技術(shù)要求各一式兩份。
(2)2014年10月1日前已獲準(zhǔn)注冊在延續(xù)注冊時,注冊人按照《體外診斷試劑注冊與備案管理辦法》規(guī)定提交資料,同時提交原注冊產(chǎn)品標(biāo)準(zhǔn)原件,產(chǎn)品技術(shù)要求、產(chǎn)品技術(shù)要求與原注冊產(chǎn)品標(biāo)準(zhǔn)的對比說明;最小銷售單元的標(biāo)簽設(shè)計樣稿;如說明書與原經(jīng)注冊審查的說明書有變化的,應(yīng)提供更改情況對比說明。
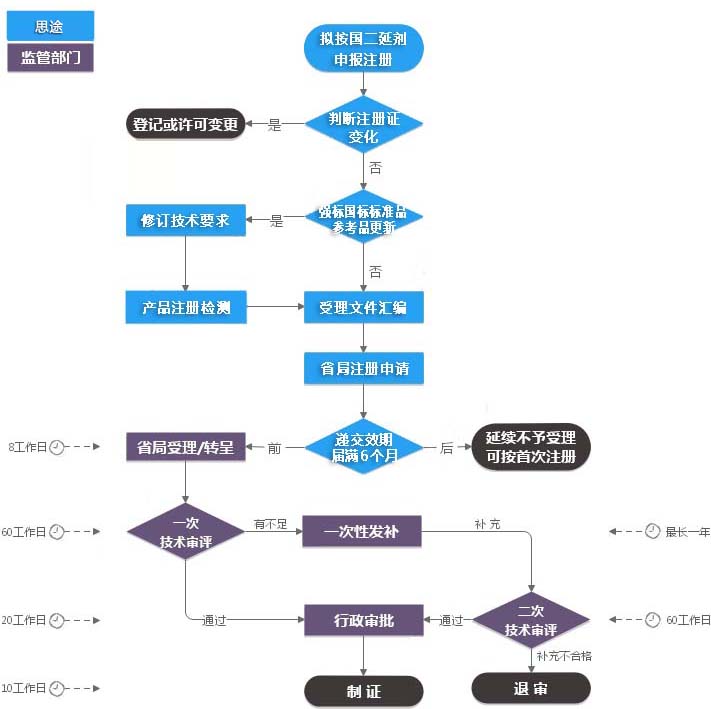
第二類IVD注冊證(延續(xù)注冊)服務(wù)流程
第二類IVD注冊證(延續(xù)注冊)收費標(biāo)準(zhǔn)
| 主管部門 | 管理類別 | 首次注冊 | 注冊變更 (許可事項變更) | 延續(xù)注冊 (五年一次) | 相關(guān)文件 | 實施日期 | ||
|---|---|---|---|---|---|---|---|---|
| 省 局 | 1 | 福建省 | Ⅱ | 5.77 | 2.42 | 2.39 | 閩發(fā)改服價函〔2021〕 361號 | 2021/9/1 |
| 2 | 江西省 | Ⅱ | 3.8272 | 1.602 | 1.587 | 贛發(fā)改價管〔2023〕670號 | 2023/11/1 | |
| 3 | 上海市 | Ⅱ | 2.3005.5 | 0.9628.5 | 0.9555 | 滬藥監(jiān)公告﹝2024﹞1號 | 2024年4月1日 (截止25年12月31日) | |
| 4 | 海南省 | Ⅱ | 4.067 | 1.6856 | 1.6709 | 瓊發(fā)改收費〔2021〕424號 | 2021/6/15 | |
| 5 | 山東省 | Ⅱ | 4.6 | 1.92 | 1.9 | 魯發(fā)改成本[2022]761號 | 2022/9/30 (截止25年10月7日) | |
| 6 | 安徽省 | Ⅱ | 4.5045 | 1.4651 | 1.0395 | 皖發(fā)改價費函〔2024〕440號 | 2023/12/29 (截止26年1月1日) | |
| 7 | 浙江省 | Ⅱ | 4.6011 | 1.5405 | 1.5288 | 浙藥監(jiān)械[2023]2號 | 2023/8/31 | |
| 8 | 山西省 | Ⅱ | 1.26 | 0.48 | 0.48 | 晉發(fā)改收費發(fā)〔2023〕361號 | 2023/9/18 | |
| 9 | 云南省 | Ⅱ | 0 | 0 | 0 | / | / | |
| 10 | 河北省 | Ⅱ | 0 | 0 | 0 | / | / | |
| 11 | 江蘇省 | Ⅱ | 5.915 小微企業(yè)免征 | 2.471 | 2.457 | 蘇發(fā)改收管發(fā)[2019]91號 | 2019/2/13 | |
| 12 | 寧夏 | Ⅱ | 0.75 | 0.325 | 0 | 寧發(fā)改價格(調(diào)控)函〔2025〕53號 | 2025/2/19 | |
| 13 | 黑龍江 | Ⅱ | 3.312 | 1.403 | 1.38 | 黑發(fā)改價格〔2020〕712 號 | 2024/6/10 | |
| 14 | 廣東省 | Ⅱ | 5.726 | 2.394 | 2.38 | 粵發(fā)改價格函〔2019〕666號 | 2019/2/25 | |
| 15 | 湖南省 | Ⅱ | 5.04 | 2.114 | 2.1 | 湘發(fā)改價費規(guī)〔2024〕416號 | 2024/6/10 | |
| 16 | 四川省 | Ⅱ | 3.90 | 1.60 | 1.60 | 川發(fā)改價格〔2024〕585號 | 2024/12/1 (截止2029年12月1日) | |
| 17 | 貴州省 | Ⅱ | 2.145 | 0.88 | 0.88 | 黔發(fā)改價格〔2024〕787號 | 2024/12/31 | |
| 18 | 廣西 | Ⅱ | 2.0187 | 1.264 | 0 | 桂發(fā)改價費函〔2024〕1327號 | 2024/6/11 | |
| 19 | 遼寧省 | Ⅱ | 5 | 2.1 | 2.1 | 遼藥監(jiān)告〔2023〕70號 | 2023/7/20 | |
| 20 | 吉林省 | Ⅱ | 0 | 0 | 0 | 吉政發(fā)〔2020〕4號 | 2020/2/8 | |
| 21 | 湖北省 | Ⅱ | 0 | 0 | 0 | / | / | |
| 22 | 河南省 | Ⅱ | 0 | 0 | 0 | / | / | |
| 23 | 重慶市 | Ⅱ | 0 | 0 | 0 | 渝府辦發(fā)〔2019〕56號 | 2019/5/15 | |
| 24 | 甘肅省 | Ⅱ | 0 | 0 | 0 | / | / | |
| 25 | 新疆 | Ⅱ | 0.28 | 0.24 | 0.12 | 新發(fā)改收費〔2024〕158 號 | 2024/4/18 | |
| 26 | 內(nèi)蒙古 | Ⅱ | 0 | 0 | 0 | 內(nèi)發(fā)改費字〔2019〕773號 | 2019/9/17 | |
| 27 | 北京市 | Ⅱ | 0 | 0 | 0 | 京發(fā)改[2019]569號 | 2019/4/25 | |
| 28 | 天津市 | Ⅱ | 0 | 0 | 0 | 津黨發(fā)[2018]39號 | 2019/1/4 | |
| 29 | 陜西省 | Ⅱ | 0 | 0 | 0 | 陜財稅[2019]26號 | 2020/1/10 | |
更新時間:2025年5月6日
單位:萬元
第二類IVD注冊證(延續(xù)注冊)辦理依據(jù)
| 文件名稱 | 文號 |
|---|---|
| 《醫(yī)療器械監(jiān)督管理條例》 | 650號文件 |
| 《體外診斷試劑注冊與備案管理辦法》 | 市場監(jiān)督管理總局令第48號 |
第二類IVD注冊證(延續(xù)注冊)服務(wù)周期
立項階段
預(yù)算、合同、考慮期,3個工作日。
受理前資料準(zhǔn)備
資料收集(客戶提供資料;新標(biāo)準(zhǔn)指南文獻檢索;變更判斷) 1個月
產(chǎn)品技術(shù)要求修訂,預(yù)算估計至少20個工作日 1個月
*產(chǎn)品檢測(如需),約3個月。 *3個月
延續(xù)注冊申報資料編制 2-3個月
受理后
CFDA法定消耗預(yù)算3個月。(93工日,24工日/月,不計節(jié)假) 至少3個月
*發(fā)補(如適用):1、發(fā)補資料準(zhǔn)備時限0~6個月視產(chǎn)品遞交的申報資料情況而定。 *平均3個月
*發(fā)補(如適用):2、發(fā)補技術(shù)評審時間預(yù)計消耗2個月(60工作日) *2個月
預(yù)算合計
無需發(fā)補,在75個工作日完成。
需要發(fā)補,至少需要105個工作日完成。
第二類IVD注冊證(延續(xù)注冊)相關(guān)服務(wù)
| 延注資料收集服務(wù) | 產(chǎn)品技術(shù)要求修訂服務(wù) |
| 延注申報資料編寫服務(wù) | 資料申報服務(wù)(直到拿證) |
| 延伸:二類IVD產(chǎn)品注冊服務(wù) | 延伸:ivd臨床試驗服務(wù) |
| 延伸:GMP年度輔導(dǎo)服務(wù) |

立即咨詢
 最新文章
最新文章 2025-08-31
2025-08-31 2025-08-31
2025-08-31 2025-08-31
2025-08-31 2025-08-31
2025-08-31 2025-08-31
2025-08-31 精選案例
精選案例
遠(yuǎn)紅外穴位貼/前列腺遠(yuǎn)紅外穴位貼臨床試驗注冊案例
醫(yī)用疤痕/遠(yuǎn)紅外治療凝膠臨床試驗注冊案例
脈沖磁場穴位治療儀同品種比對產(chǎn)品注冊案例

生物玻璃創(chuàng)面無機敷料醫(yī)療器械產(chǎn)品注冊證申辦案例

牙齒脫敏劑醫(yī)療器械注冊免臨床GMP案例

醫(yī)用冷凍箱醫(yī)療器械注冊免臨床體系建立案例

醫(yī)用冷藏箱醫(yī)療器械注冊GMP體系認(rèn)證案例
定制式活動義齒醫(yī)療器械注冊證變更案例
醫(yī)用紅外額溫計(額溫槍)臨床驗證注冊案例
下肢運動康復(fù)訓(xùn)練機產(chǎn)品注冊體系案例
八年
醫(yī)療器械服務(wù)經(jīng)驗
-
多一份參考,總有益處
聯(lián)系思途,免費獲得專屬《落地解決方案》及報價
咨詢相關(guān)問題或咨詢報價,可以直接與我們聯(lián)系
思途CRO——醫(yī)療器械注冊臨床第三方平臺
- 在線咨詢
- 在線客服
- 服務(wù)熱線
北京公司
186-0382-3911鄭州公司
186-0382-3910合肥公司
188-5696-0331 - 微信咨詢

- 返回頂部


 豫公網(wǎng)安備 41010202003160號
豫公網(wǎng)安備 41010202003160號