附件:腔鏡用吻合器產(chǎn)品注冊技術(shù)審查指導(dǎo)原則(2017年第44號).doc
腔鏡用吻合器產(chǎn)品注冊技術(shù)審查指導(dǎo)原則
本指導(dǎo)原則旨在為申請人進行腔鏡用吻合器產(chǎn)品的注冊申報提供技術(shù)指導(dǎo),同時也為食品藥品監(jiān)督管理部門對注冊申報資料的審評提供技術(shù)參考。
本指導(dǎo)原則是對腔鏡用吻合器產(chǎn)品注冊申報資料的一般要求,申請人應(yīng)依據(jù)具體產(chǎn)品的特性對注冊申報資料的內(nèi)容進行充實和細化,并依據(jù)具體產(chǎn)品的特性確定其中的具體內(nèi)容是否適用,若不適用,需具體闡述其理由及相應(yīng)的科學(xué)依據(jù)。
本指導(dǎo)原則是對申請人和審查人員的指導(dǎo)性文件,但不包括注冊審批所涉及的行政事項,亦不作為法規(guī)強制執(zhí)行,如果有能夠滿足相關(guān)法規(guī)要求的其他方法,也可以采用,但是需要提供詳細的研究資料和驗證資料。應(yīng)在遵循相關(guān)法規(guī)和標準的前提下使用本指導(dǎo)原則。
本指導(dǎo)原則是在現(xiàn)行法規(guī)和標準體系以及當(dāng)前認知水平下制定的,隨著法規(guī)和標準的不斷完善,以及科學(xué)技術(shù)的不斷發(fā)展,本指導(dǎo)原則相關(guān)內(nèi)容也將進行適時的調(diào)整。
一、適用范圍
本指導(dǎo)原則的適用范圍為腔鏡下使用的吻合器。該類吻合器可帶或不帶切割功能,主要用于腔鏡下組織/臟器的切除、閉合及消化道重建。
二、注冊申報資料要求
(一)綜述資料
1.概述
產(chǎn)品名稱依據(jù)《醫(yī)療器械通用名稱命名規(guī)則》確定。根據(jù)吻合后釘?shù)呐帕行螤睿擅麨榍荤R用直線型吻合器、腔鏡用管型吻合器、腔鏡用弧線型吻合器等,若同時有切割功能,名稱中可帶有“切割”字樣,根據(jù)吻合器器身是一次性使用或可重復(fù)使用,產(chǎn)品名稱中可帶有“一次性”或“可重復(fù)使用”字樣。如:產(chǎn)品名稱可為一次性腔鏡用直線型吻合器、一次性腔鏡用直線型切割吻合器。
2.產(chǎn)品描述
產(chǎn)品描述應(yīng)全面、詳細,至少應(yīng)包括申報產(chǎn)品名稱、結(jié)構(gòu)組成(含配合使用的附件)、工作原理、主要原材料、性能、預(yù)期用途、適用的解剖部位,以及區(qū)別于其他同類產(chǎn)品的特征等內(nèi)容。必要時提供圖示說明。
(1)結(jié)構(gòu)組成
通常情況下一套完整的腔鏡用吻合器(以下簡稱“吻合器”)最基本組成是器身和組件;器身由手柄、保險裝置、旋轉(zhuǎn)環(huán)、關(guān)節(jié)旋鈕、釘砧(又名抵釘座)和釘砧釋放鈕等組成。吻合器中可更換部分通常稱為組件,組件一般包括釘倉(釘匣)、吻合釘和推釘片。根據(jù)產(chǎn)品設(shè)計不同,切割刀可裝配于器身或組件。
典型產(chǎn)品的結(jié)構(gòu)示意圖如下:
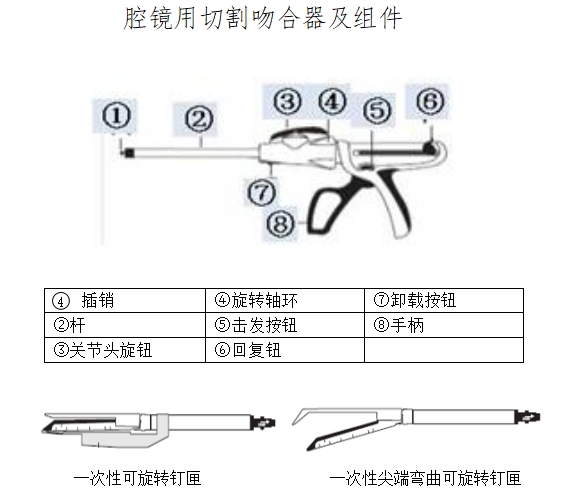
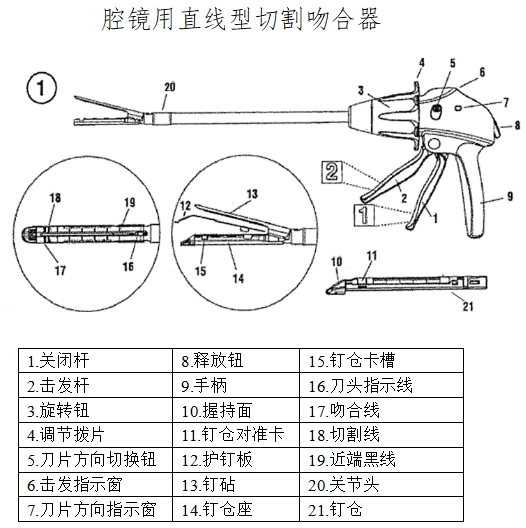
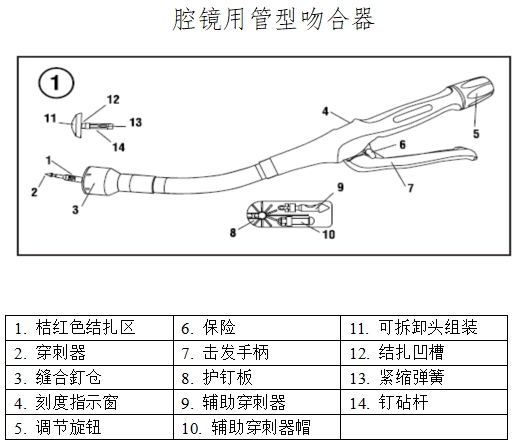
(2)工作原理
吻合器通過機械傳動裝置,將預(yù)先放置在組件中呈兩排或數(shù)排互相平行錯位排列的吻合釘,擊入已經(jīng)對合好需要吻合在一起的組織內(nèi),吻合釘在穿過組織后受到前方釘砧阻擋,向內(nèi)彎曲,形成類“B”形互相錯位排列,將組織吻合在一起。由于小血管可以從“B”形吻合釘空隙中通過,故不影響吻合部位及其遠端的血液供應(yīng)。
3.型號規(guī)格
對于存在多種型號規(guī)格的產(chǎn)品,說明型號規(guī)格的劃分依據(jù)、明確各型號規(guī)格的區(qū)別。可采用對比表或帶有說明性文字的圖片、圖表,對不同型號規(guī)格的結(jié)構(gòu)組成、性能指標加以描述。
4.包裝說明
有關(guān)產(chǎn)品包裝的信息,以及與該產(chǎn)品一起銷售的配件包裝情況。說明與滅菌方法相適應(yīng)的最初包裝的信息。
5.產(chǎn)品適用范圍和禁忌癥
(1)適用范圍:應(yīng)當(dāng)明確產(chǎn)品的適用范圍,包括預(yù)期應(yīng)用的解剖部位、配合使用的器械(如適用)。
(2)適用人群:目標患者人群的信息(如成人、兒童),患者選擇標準的信息。
(3)禁忌癥:如適用,應(yīng)當(dāng)明確說明該產(chǎn)品禁忌應(yīng)用的特定人群、疾病種類等。
6.參考的同類產(chǎn)品或前代產(chǎn)品情況
應(yīng)當(dāng)提供同類產(chǎn)品(國內(nèi)外已上市)或前代產(chǎn)品(如有)的信息,闡述申請注冊產(chǎn)品的研發(fā)背景和目的。對于同類產(chǎn)品,應(yīng)當(dāng)說明選擇其作為研發(fā)參考的原因。
申請人應(yīng)綜述該類產(chǎn)品國內(nèi)外研究及臨床使用現(xiàn)狀。列表比較說明本次申報產(chǎn)品與已上市同類及前代產(chǎn)品(如有)的相同點和不同點,比較的項目應(yīng)包括工作原理、結(jié)構(gòu)組成、原材料、性能指標、適用范圍、生產(chǎn)工藝、滅菌方式、有效期、已上市國家等。
吻合器及吻合釘?shù)牟牧蠎?yīng)符合行業(yè)標準YY0875-2013《直線型吻合器及組件》(本指導(dǎo)原則中標準適用最新版本,下同)、YY 0876-2013《直線型切割吻合器及組件》中對原材料的規(guī)定。
明確產(chǎn)品全部原材料、供應(yīng)商、符合的標準等基本信息,建議以列表的形式提供。說明原材料的選擇依據(jù)及來源。原材料應(yīng)具有穩(wěn)定的供貨渠道以保證產(chǎn)品質(zhì)量,需提供原材料生產(chǎn)廠家的資質(zhì)證明及外購協(xié)議。應(yīng)明確所用原材料的質(zhì)控標準及生產(chǎn)過程中的檢驗步驟,提交原材料符合相應(yīng)標準的全性能驗證報告。
對于首次應(yīng)用于醫(yī)療器械的新材料,應(yīng)提供該材料適合用于人體預(yù)期使用部位的相關(guān)研究資料。
7.其他需要說明的內(nèi)容。
(二)研究資料
至少應(yīng)包含如下內(nèi)容:
1.產(chǎn)品性能研究
應(yīng)當(dāng)提供產(chǎn)品性能研究資料以及產(chǎn)品技術(shù)要求的研究和編制說明,包括有效性、安全性指標以及與質(zhì)量控制相關(guān)的其他指標的確定依據(jù)、所采用的標準或方法、采用的原因及理論基礎(chǔ)等。
應(yīng)研究的產(chǎn)品基本性能包括外觀、尺寸、表面粗糙度、吻合釘材料(牌號及化學(xué)成分)、硬度(關(guān)鍵部件、切割刀)、吻合釘材料拉伸強度、靈活性(開閉靈活性、復(fù)位彈簧彈性、有效擊發(fā)指示區(qū))、裝配性、閉合力、夾持力及其均勻性、吻合性能(成型吻合釘高度、吻合釘成型質(zhì)量、縫釘線完整性)、切割性能、切割刀鋒利度、吻合口耐壓性能、保險及安全裝置、耐腐蝕性(切割刀、抵釘座)、氣密性(若適用)、抵釘座與釘倉的安全間隙、包裝密封性及包裝封口剝離強度、無菌、熱原、環(huán)氧乙烷殘留量(若適用)及其他對人體有潛在危害物質(zhì)的殘留量等。
若產(chǎn)品帶有配合使用的附件,應(yīng)分別列出附件的材料、尺寸、性能要求。
對于采用新材料制造的產(chǎn)品以及具有其他特殊性能的產(chǎn)品,申請人應(yīng)根據(jù)產(chǎn)品特點制定相應(yīng)的性能要求,設(shè)計驗證該項特殊性能的試驗方法,闡明試驗方法的來源或提供方法學(xué)確認資料。
可參照的相關(guān)標準舉例如下(未標明年代號表示應(yīng)參照最新版本):
GB 1220不銹鋼棒
GB/T 3280不銹鋼冷軋鋼板和鋼帶
GB/T 228.1金屬材料拉伸試驗第1部分:室溫試驗方法
GB/T 230.1金屬材料洛氏硬度試驗第1部分:試驗方法(A、B、C、D、E、F、G、H、K、N、T標尺)
GB/T 4340.1金屬材料維氏硬度試驗第1部分:試驗方法
GB/T13810外科植入物用鈦及鈦合金加工材
GB/T 14233.1醫(yī)用輸液、輸血、注射器具檢驗方法第1部分:化學(xué)分析方法
GB/T 14233.2醫(yī)用輸液、輸血、注射器具檢驗方法第2部分:生物學(xué)試驗方法
YY 0875直線型吻合器及組件
YY 0876直線型切割吻合器及組件
YY/T 0149不銹鋼醫(yī)用器械耐腐蝕性能試驗方法
YY/T 0294.1 外科器械金屬材料第1部分:不銹鋼
中華人民共和國藥典
ISO 13782外科植入物金屬材料外科植入用純鉭材料
2.生物相容性評價研究
對吻合器中與人體接觸的部件,如抵釘座、釘倉等應(yīng)按照GB/T 16886《醫(yī)療器械生物學(xué)評價》系列標準對吻合器進行生物相容性評價。一般應(yīng)評價的項目包括細胞毒性、致敏和皮內(nèi)反應(yīng)等。
吻合釘目前多采用鈦、鈦合金或純鉭材料。制成吻合釘?shù)募冣仭⑩伜辖鸩牧蠎?yīng)符合GB/T13810中鈦或鈦合金材料(TA1、TA2、TA3、TC4)的化學(xué)成分要求;制成吻合釘?shù)募冦g材料應(yīng)符合ISO13782中純鉭材料(Tal)的化學(xué)成分要求。選用表面改性處理的純鈦、鈦合金、純鉭或其他材料,應(yīng)按照GB/T 16886《醫(yī)療器械生物學(xué)評價》系列標準對吻合釘進行生物相容性評價研究,一般包括但不限于細胞毒性、致敏、皮內(nèi)反應(yīng)、急性毒性、亞慢性毒性、遺傳毒性和植入后局部反應(yīng)。
以下參考標準未標明年代號表示應(yīng)參照最新版本:
GB/T 16886.1醫(yī)療器械生物學(xué)評價第1部分:風(fēng)險管理過程中的評價與試驗
GB/T 16886.3醫(yī)療器械生物學(xué)評價第3部分:遺傳毒性、致癌性和生殖毒性試驗
GB/T 16886.5醫(yī)療器械生物學(xué)評價第5部分:體外細胞毒性試驗
GB/T 16886.6醫(yī)療器械生物學(xué)評價第6部分:植入后局部反應(yīng)試驗
GB/T 16886.10醫(yī)療器械生物學(xué)評價第10部分:刺激與遲發(fā)型超敏反應(yīng)試驗
GB/T 16886.11醫(yī)療器械生物學(xué)評價第11部分:全身毒性試驗
3.滅菌工藝研究
(1)應(yīng)明確滅菌工藝(方法和參數(shù))及其選擇依據(jù)和無菌保證水平(SAL),并提供滅菌確認報告。腔鏡用吻合器的無菌保證水平(SAL)應(yīng)達到1×10-6。
(2)對于可重復(fù)使用的吻合器,應(yīng)當(dāng)明確推薦的滅菌工藝(方法和參數(shù))及推薦滅菌方法的確定依據(jù),提供器械對所推薦滅菌方法耐受性的研究資料。
(3)殘留毒性:若滅菌使用的方法容易出現(xiàn)殘留,如環(huán)氧乙烷滅菌,應(yīng)當(dāng)明確殘留物信息及采取的處理方法,并提供研究資料。
4.產(chǎn)品貨架有效期和包裝研究
(1)產(chǎn)品貨架有效期
貨架有效期包括產(chǎn)品有效期和包裝有效期。產(chǎn)品有效期驗證可采用實時老化或加速老化的研究。實時老化的研究是唯一能夠反映產(chǎn)品在規(guī)定儲存條件下實際穩(wěn)定性要求的方法。加速老化試驗選擇的環(huán)境條件的老化機制應(yīng)與宣稱的真實運輸儲存條件下發(fā)生產(chǎn)品老化的機制相匹配。加速老化研究報告中應(yīng)明確試驗溫度、濕度、加速老化時間的確定依據(jù)。
(2)產(chǎn)品包裝研究
可依據(jù)有關(guān)國內(nèi)、國際標準進行(如GB/T 19633、ISO 11607、ASTM F2475、ASTM D4169等)包裝研究,提交產(chǎn)品的包裝驗證報告。直接接觸產(chǎn)品的包裝材料的選擇應(yīng)至少考慮以下因素:包裝材料的物理化學(xué)性能;包裝材料的毒理學(xué)特性;包裝材料與產(chǎn)品的適應(yīng)性;包裝材料與成型和密封過程的適應(yīng)性;包裝材料與滅菌過程的適應(yīng)性;包裝材料所能提供的物理、化學(xué)和微生物屏障保護;包裝材料與使用者使用時的要求(如無菌開啟)的適應(yīng)性;包裝材料與標簽系統(tǒng)的適應(yīng)性;包裝材料與貯存運輸過程的適應(yīng)性。
吻合器與組件分開包裝的,應(yīng)分別對其有效期和包裝進行研究。
5.臨床前動物實驗
吻合器在進行人體臨床試驗前應(yīng)進行動物實驗。臨床前動物實驗的目的主要是通過相關(guān)動物來考察產(chǎn)品的安全性和有效性,以及臨床相關(guān)參數(shù)(如組織厚度)的確定,預(yù)測其在人群中使用時可能出現(xiàn)的不良事件,降低臨床試驗受試者和臨床使用者承擔(dān)的風(fēng)險,并為臨床試驗方案的制定提供依據(jù)。建議在具有資質(zhì)的實驗室進行臨床前動物實驗。
建議申請人建立與擬申報產(chǎn)品預(yù)期用途相對應(yīng)的各個解剖部位應(yīng)用的動物模型。
建議動物實驗方案嚴格按照產(chǎn)品適用范圍和使用方法制定。應(yīng)至少評價以下指標:
(1)有效性評價指標
有效性評價指標應(yīng)包括即刻吻合成功率、吻合口愈合率、吻合口耐壓性能等。
(2)安全性評價指標
安全性評價指標主要為吻合口并發(fā)癥(主要為吻合口出血、吻合口瘺及吻合口狹窄)、吻合口周圍瘢痕組織增生情況、肺實質(zhì)滲漏及肺不張(若適用)。還應(yīng)包括動物的生理狀態(tài)及不良事件,如動物外觀體征、行為活動、體溫、局部刺激性、腺體分泌、糞便性狀、攝食量、體重、血液學(xué)和血液生化學(xué)指標(如肝功能、腎功能等)、大體解剖和組織病理學(xué)檢查等指標。
申請人應(yīng)對動物實驗中有關(guān)安全事件進行完整的記錄,分析原因并判定與器械的關(guān)聯(lián)性,為產(chǎn)品風(fēng)險分析和下一步的臨床試驗奠定理論基礎(chǔ)。
為保證人類受試者的合法權(quán)益,只有在獲得充分動物實驗數(shù)據(jù),且能證明產(chǎn)品對受試者無潛在安全性擔(dān)憂時才可考慮進行臨床試驗。
動物實驗研究中,建議申請人根據(jù)擬申報器械的性能結(jié)構(gòu)特點及臨床使用情況,選取合適的對照產(chǎn)品。實驗例數(shù)的選擇應(yīng)符合統(tǒng)計學(xué)原則。
申請人應(yīng)提交詳細的動物實驗研究方案和研究報告。應(yīng)至少包括但不局限于以下內(nèi)容:
①實驗?zāi)康?/p>
②實驗器材和試劑
③動物的種類、數(shù)量、動物微生物級別和飼養(yǎng)環(huán)境以及該種類作為受試動物的合理性解釋及選擇依據(jù)
④實驗方法(樣品準備、動物準備、手術(shù)方法)、術(shù)前準備等
⑤對照組類型和/或?qū)φ债a(chǎn)品的類型和選取依據(jù)
⑥動物模型的種類及建立方法
⑦產(chǎn)品的使用方法
⑧觀察方法與觀察指標
⑨數(shù)據(jù)統(tǒng)計學(xué)分析
⑩結(jié)果判定標準與實驗結(jié)論
應(yīng)提交原始實驗數(shù)據(jù)。
6.其他資料
結(jié)合申報產(chǎn)品的特點,證明產(chǎn)品安全性、有效性的其他研究資料。
(三)生產(chǎn)制造信息
應(yīng)當(dāng)明確產(chǎn)品生產(chǎn)加工工藝,注明關(guān)鍵工藝和特殊工藝,并闡明其過程控制點及控制參數(shù)。對生產(chǎn)工藝的可控性、穩(wěn)定性應(yīng)進行確認。
吻合釘若選用表面改性處理(涂層、酸蝕等)的金屬材料(如純鈦、鈦合金材料、純鉭等),需要給出改性層或涂層的元素成分、組織結(jié)構(gòu)、理化性能、結(jié)合強度等信息及其相關(guān)的制備工藝。
明確生產(chǎn)工藝的質(zhì)量控制標準以及加工助劑殘留控制的驗證資料。
(四)臨床評價資料
對于按照《醫(yī)療器械注冊管理辦法》規(guī)定,通過對同品種醫(yī)療器械臨床試驗或者臨床使用獲得的數(shù)據(jù)進行分析評價提交臨床評價資料的,臨床評價資料應(yīng)符合《醫(yī)療器械臨床評價技術(shù)指導(dǎo)原則》的規(guī)定。
對于按照《醫(yī)療器械注冊管理辦法》規(guī)定需要進行臨床試驗的吻合器產(chǎn)品,臨床試驗應(yīng)符合《醫(yī)療器械臨床試驗質(zhì)量管理規(guī)范》有關(guān)要求。
1.臨床適應(yīng)癥的選擇
詳細說明試驗對象的選擇范圍、納入標準和排除標準,對照組的設(shè)置情況。
臨床試驗選擇的手術(shù)部位和/或組織類型及厚度應(yīng)能覆蓋產(chǎn)品擬申報的臨床適用范圍。
2.評價指標
評價指標應(yīng)包括有效性指標、安全性指標及術(shù)中操作性能評估指標。有效性評價指標應(yīng)明確主要有效性評價指標和次要有效性評價指標,評價的指標應(yīng)合理并便于臨床觀察,應(yīng)包括術(shù)中直接觀察到的及術(shù)后通過輔助檢查或患者癥狀及隨訪可以獲得的信息。
以用于消化道(切割)吻合的腔鏡下使用吻合器為例:
(1)有效性評價指標
①主要有效性評價指標:在手術(shù)中進行消化道的橫斷和吻合,擊發(fā)成功后退出器械,仔細檢查切割吻合環(huán)/吻合線是否完整,有無滲漏、出血。若吻合環(huán)完整,無滲漏、出血則視為吻合成功,否則視為吻合失敗。必要時采用注氣法進行檢驗,觀察吻合口是否有氣泡溢出,無氣泡溢出記錄為吻合成功,有明顯氣泡溢出記錄為吻合失敗。
②次要有效性評價指標:為術(shù)后吻合口愈合情況,主要通過腸鳴音恢復(fù)情況、進食和排便情況進行判斷。腸鳴音恢復(fù),能順利進食和排便視為吻合口愈合。
③其他觀察指標:包括術(shù)中情況(如:手術(shù)時間、吻合時間、因吻合器原因?qū)е碌闹修D(zhuǎn)率、吻合后需要手工間斷縫合加固的針數(shù)等),術(shù)前及術(shù)后的生命體征和實驗室檢查情況(血常規(guī)、生化指標等)。
(2)安全性評價指標:術(shù)中因爆釘致吻合口裂開情況;術(shù)后并發(fā)癥情況,包括吻合口出血、吻合口漏、感染等。
①吻合口出血:術(shù)后出現(xiàn)消化道出血并通過觀察消化腔減壓管及腹腔內(nèi)引流管、內(nèi)鏡、血管造影等明確為吻合口來源者,若未能明確來源則稱為消化道出血。
②根據(jù)文獻報道出現(xiàn)下述至少一項者為吻合口漏:A.影像學(xué)檢查如消化道造影證實吻合口漏;B.腹腔引流管或切口內(nèi)出現(xiàn)糞性物質(zhì),并可排除腸道其他部位來源;C.再次手術(shù)探查證實為吻合口漏;D.吻合口旁的腹盆腔膿腫。吻合口漏根據(jù)嚴重程度分為3級:A級:不需要特別處理;B級:需要積極處理,但是不需要再次手術(shù);C級:需要再次手術(shù)。
(3)吻合器操作性能評估
①吻合器單手操作是否順暢;
②吻合器能否正常擊發(fā);
③吻合完畢后回退是否順暢、有無卡壓組織、有無阻力;
④吻合器多次連續(xù)擊發(fā)是否可靠;
⑤吻合器是否能完全切斷組織。
3.研究設(shè)計和研究假設(shè)
建議申請人采用前瞻性、隨機對照設(shè)計,將擬申報器械與已獲準上市器械進行對比。對照器械應(yīng)與擬申報器械采用類似的材料制成且具有相同/相似的預(yù)期用途。
對各臨床試驗中心的入選受試者進行分組時,應(yīng)盡可能基于重要的非試驗因素進行分層隨機化。
4.比較的類型
如優(yōu)效性檢驗、非劣效檢驗、等效性檢驗,申請人應(yīng)說明選擇的依據(jù)。
若選用非劣效檢驗,應(yīng)選擇已上市的行業(yè)內(nèi)及臨床公認的性能優(yōu)異的同類吻合器作為對照器械。
5.樣本量確定依據(jù)
試驗例數(shù)應(yīng)具有統(tǒng)計學(xué)意義,應(yīng)足以確保所申報器械將能在臨床使用條件下充分發(fā)揮作用。
樣本量的大小應(yīng)根據(jù)如下要素確定:
(1)受試產(chǎn)品的具體特性、主要有效性評價指標及其估計值。
(2)比較的類型(優(yōu)效性檢驗、等效性檢驗、非劣效檢驗)。
對于非劣效和等效性試驗,應(yīng)給出具有臨床意義的非劣效界值和/或等效性界值,若為優(yōu)效性試驗,需要給出優(yōu)效性界值。
(3)顯著性水平、Ⅰ類錯誤概率α值為雙側(cè)0.05(即單側(cè)0.025),Ⅱ類錯誤概率β通常不超過0.2(即單側(cè)0.1)。
應(yīng)在臨床試驗方案中明確給出具體的樣本量計算公式及其來源出處,說明計算過程中所采用的所有參數(shù)及其估計值。如果對多個指標進行計算,得出不同估計值,則取最大者。使例數(shù)滿足所有指標應(yīng)具有統(tǒng)計學(xué)意義。
(4)應(yīng)考慮20%以內(nèi)的脫落率。故根據(jù)樣本例數(shù)計算公式計算的樣本數(shù),加20%的樣本數(shù)。
6.統(tǒng)計分析方法
應(yīng)在方案中明確寫出將要采用的統(tǒng)計分析方法。所有統(tǒng)計分析均應(yīng)在全分析集、符合方案集進行,對于未能觀察到安全性或有效性終點的受試者,必須進行靈敏度分析,并按照失敗或者無效計算。
(1)描述性分析
計數(shù)資料采用頻數(shù)和百分比描述,計量資料采用均數(shù)、標準差、最大值、最小值、中位數(shù)、第25及第75分位數(shù)描述。
(2)臨床觀察指標的統(tǒng)計學(xué)分析
基線統(tǒng)計除按上述描述性分析外,對觀察指標(計數(shù)資料和計量資料)的組間比較應(yīng)根據(jù)觀察指標的性質(zhì)選擇相應(yīng)的統(tǒng)計方法進行統(tǒng)計分析檢驗。
(3)安全性評價
報告不良事件發(fā)生例數(shù)及所占比例,并進行組間比較。同時,詳細描述各組病例出現(xiàn)的全部不良事件的具體表現(xiàn)、程度及其與所使用的研究器械的關(guān)系。
7.試驗所用樣品的信息
應(yīng)具體說明臨床試驗樣品的詳細信息:產(chǎn)品規(guī)格型號、批號、使用方法,對照品的詳細信息(生產(chǎn)廠家、產(chǎn)品材料、預(yù)期用途、使用方法、產(chǎn)品規(guī)格型號、批號、醫(yī)療器械注冊證號等)。
8.患者隨訪
建議必要時對臨床試驗中納入的患者進行隨訪。
(五)產(chǎn)品風(fēng)險分析資料
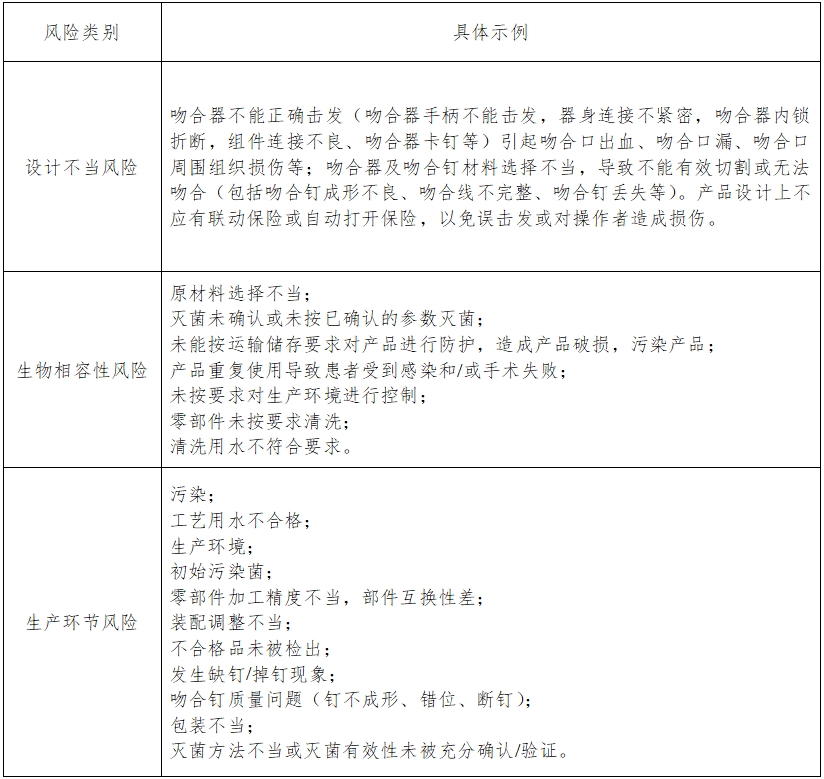

可通過產(chǎn)品設(shè)計控制、產(chǎn)品原材料選擇、生產(chǎn)工藝過程控制、產(chǎn)品技術(shù)性能指標的制定、動物實驗、臨床試驗、說明書、正確的標簽標識等多項措施對風(fēng)險進行控制,以降低風(fēng)險至可接受水平。
(六)產(chǎn)品技術(shù)要求
申請人應(yīng)結(jié)合產(chǎn)品的技術(shù)特征和臨床使用情況來確定產(chǎn)品安全有效、質(zhì)量可控的技術(shù)要求與檢驗方法。產(chǎn)品技術(shù)要求中應(yīng)包括產(chǎn)品的一般信息(結(jié)構(gòu)組成、示意圖、原材料、滅菌方法、有效期、初包裝信息)、規(guī)格型號及其劃分的說明、產(chǎn)品性能指標及試驗方法。產(chǎn)品技術(shù)要求中的內(nèi)容引用國家標準、行業(yè)標準、中國藥典或國際標準的,應(yīng)保證其有效性,并注明相應(yīng)標準的編號、年號及中國藥典的版本號。制定吻合器技術(shù)要求的常用參考標準見上述產(chǎn)品性能研究章節(jié)。吻合器性能要求一般應(yīng)包括如下項目:
1.外觀
參考YY 0875中相關(guān)要求制定。
2.尺寸(吻合長度、吻合釘高度)
3.吻合釘材料
應(yīng)符合YY 0875中的相關(guān)規(guī)定。
4.靈活性、裝配性
參考YY 0875、YY 0876中相關(guān)要求制定。
5.吻合和/或切割性能、吻合口耐壓性能、切割刀鋒利度參考YY 0875、YY 0876中相關(guān)要求制定。
6.擊發(fā)后聽覺/觸覺等反饋
7.硬度要求
重復(fù)使用吻合器的抵釘座硬度應(yīng)不低于35HRC。
申請人也可根據(jù)自己產(chǎn)品的性能制定關(guān)鍵部件的硬度要求,但需要提供完整的驗證資料予以證明。
8.表面粗糙度
吻合器金屬外表面粗糙度Ra應(yīng)不大于0.8μm。
9.耐腐蝕性能
重復(fù)性使用吻合器切割刀、抵釘座的耐腐蝕性能應(yīng)符合YY/T 0149中5.4 b級的規(guī)定。
10.安全/保護裝置
吻合器應(yīng)具有安全保護裝置,如防止空釘倉擊發(fā)的保護裝置。
11.吻合器器身與組件的連接牢固度
12.包裝密封
參考YY 0875制定。
13.滅菌
14.環(huán)氧乙烷殘留量
15.吻合器附件性能(若有)
16.化學(xué)性能(若適用)
產(chǎn)品技術(shù)要求中的性能指標不應(yīng)低于相關(guān)行業(yè)標準(如YY 0875、YY 0876)中的適用條款的相關(guān)要求,檢驗方法應(yīng)采用行業(yè)標準中的方法,若采用其他方法則應(yīng)選擇經(jīng)驗證的方法并說明原因。
對宣稱的所有其他技術(shù)參數(shù)和功能,均應(yīng)在產(chǎn)品技術(shù)要求中予以規(guī)定。
產(chǎn)品技術(shù)要求的編制說明應(yīng)說明產(chǎn)品性能指標及試驗方法制訂的依據(jù)。
(七)產(chǎn)品注冊檢驗報告
申請人應(yīng)提供具有醫(yī)療器械檢驗資質(zhì)的醫(yī)療器械檢驗機構(gòu)出具的注冊檢驗報告和預(yù)評價意見。此外,還應(yīng)提供檢驗樣品規(guī)格型號的選擇依據(jù)。
所檢驗型號產(chǎn)品應(yīng)當(dāng)是本注冊單元內(nèi)能夠代表申報的其他型號產(chǎn)品安全性和有效性的典型產(chǎn)品,若一個型號不能覆蓋,除選擇典型型號進行全性能檢驗外,還應(yīng)選擇其他型號進行差異性檢驗。
(八)產(chǎn)品說明書和標簽
產(chǎn)品說明書和標簽應(yīng)符合《醫(yī)療器械說明書和標簽管理規(guī)定》的要求。
說明書開頭部分建議給予“使用前請仔細閱讀說明書全部內(nèi)容,不仔細按說明操作將會導(dǎo)致嚴重的手術(shù)后果,如吻合口裂開或滲漏”的提示。
1.適應(yīng)癥
應(yīng)列出手術(shù)種類、吻合的解剖部位,并且在某些情況下,應(yīng)說明其適用的預(yù)期患者人群。
2.禁忌癥
說明不能使用該器械的疾病或情況。
3.產(chǎn)品基本信息
規(guī)格型號、結(jié)構(gòu)組成、主要原材料、產(chǎn)品結(jié)構(gòu)圖示、主要性能(如無菌、無熱原)等信息。
4.使用說明
包括器械操作方法及步驟(建議采用文字與圖示相結(jié)合
說明使用步驟)及各步驟應(yīng)注意的情況。
應(yīng)提示使用者注意該器械與附件(釘倉)的兼容性。
應(yīng)明確MRI磁共振兼容性及限定MRI使用條件。
5.警告及預(yù)防措施
舉例如下:
● 微創(chuàng)操作應(yīng)由受過足夠訓(xùn)練與熟悉微創(chuàng)技術(shù)的人實施。在實施任何微創(chuàng)術(shù)前應(yīng)查閱與有關(guān)該技術(shù)及其并發(fā)癥及危害的醫(yī)學(xué)文獻。
● 不同廠家之間的微創(chuàng)設(shè)備的尺寸可能各不相同。一個手術(shù)中如果同時應(yīng)用不同廠家生產(chǎn)的微創(chuàng)手術(shù)器械及其附件,在手術(shù)前要核實其是否相兼容。
● 手術(shù)前放療可能導(dǎo)致組織改變。例如,這些改變可能引起組織增厚而超出所選吻合釘?shù)闹付ǚ秶H魏螌Σ∪耸中g(shù)前的治療都應(yīng)經(jīng)過仔細考量,可能需要更改手術(shù)技術(shù)或手術(shù)方式。
● 直到器械準備好要擊發(fā),方可釋放保險裝置。
● 擊發(fā)前一定要檢查釘砧的安全性。
● 擊發(fā)后一定要檢查吻合線處止血情況、檢查吻合是否完整及有無滲漏。
● 確保組織厚度在指定范圍內(nèi)、組織在吻合器內(nèi)均勻分布。一側(cè)組織過多可引起吻合不佳,可能會發(fā)生吻合口滲漏。
● 在組織過多或組織過厚的情況下,試圖用力擊發(fā)扳機可能導(dǎo)致縫合線不完整,有可能吻合口裂開或滲漏。此外,可能發(fā)生器械損壞或擊發(fā)失敗。
● 一次擊發(fā)必須完成。切勿部分擊發(fā)器械。不完全擊發(fā)可能導(dǎo)致吻合釘成型不正常、切割線不完全、出血并從縫合線滲漏、和/或移除器械困難。
● 一定要擊發(fā)到底,以確保縫釘正確成型及組織切割正確。
● 擠壓擊發(fā)扳機會暴露出刀片。切勿反復(fù)按壓擊發(fā)桿,這樣會導(dǎo)致吻合部位損傷。
● 在插入裝置時,確保保險處于關(guān)閉位置以避免擊發(fā)桿不慎啟動,導(dǎo)致刀片意外暴露及吻合釘過早的部分或全部展開。
● 接觸過體液的器械應(yīng)特別處置以防生物污染的發(fā)生。
● 器械或裝置一經(jīng)打開,不論使用與否,不得再次滅菌使用。處理前要確保鎖上保險。
● 本設(shè)備是滅菌包裝,僅限使用一次。多名患者使用可能危及設(shè)備的完整性,或存在受污染的風(fēng)險,進而可能會導(dǎo)致患者傷害。
● 說明吻合器的最大擊發(fā)次數(shù),給出“更換次數(shù)請勿超過最大擊發(fā)次數(shù)”,及“將本器械與吻合線加固材料一起使用可能會使擊發(fā)次數(shù)降低”的警示。
6.《醫(yī)療器械說明書和標簽管理規(guī)定》中要求的其他內(nèi)容。
三、參考文獻
1.《醫(yī)療器械監(jiān)督管理條例》(中華人民共和國國務(wù)院令第650號)
2.《醫(yī)療器械注冊管理辦法》(國家食品藥品監(jiān)督管理總局令第4號)
3.《醫(yī)療器械說明書和標簽管理規(guī)定》(國家食品藥品監(jiān)督管理總局令第6號)
4.《醫(yī)療器械通用名稱命名規(guī)則》(國家食品藥品監(jiān)督管理總局令第19號)
5.《醫(yī)療器械臨床試驗質(zhì)量管理規(guī)范》(國家食品藥品監(jiān)督管理總局中華人民共和國國家衛(wèi)生和計劃生育委員會令第25號)
6.《關(guān)于發(fā)布醫(yī)療器械臨床評價技術(shù)指導(dǎo)原則的通告》(國家食品藥品監(jiān)督管理總局通告2015年第14號)
7.《關(guān)于公布醫(yī)療器械注冊申報資料要求和批準證明文件格式的公告》(國家食品藥品監(jiān)督管理總局通告2014年第43號)
8.YY 0875-2013 直線型吻合器及組件
9.YY 0876-2013 直線型切割吻合器及組件
四、起草單位
國家食品藥品監(jiān)督管理總局醫(yī)療器械技術(shù)審評中心。

























 豫公網(wǎng)安備 41010202003160號
豫公網(wǎng)安備 41010202003160號