長江三角洲區(qū)域醫(yī)療器械注冊人制度試點工作實施方案(試行)(滬藥監(jiān)械管〔2019〕112號)
為深入貫徹落實中共中央辦公廳、國務(wù)院辦公廳印發(fā)的《關(guān)于深化審評審批制度改革鼓勵藥品醫(yī)療器械創(chuàng)新的意見》(廳字〔2017〕42號),按照國家藥品監(jiān)督管理局《關(guān)于擴大醫(yī)療器械


注冊備案 · 臨床試驗 · 體系建立輔導(dǎo) · 分類界定 · 申請創(chuàng)新
來源:醫(yī)療器械注冊代辦 發(fā)布日期:2024-05-27 閱讀量:次
附件:腦電圖機產(chǎn)品注冊審查指導(dǎo)原則(2024年第19號).doc
本指導(dǎo)原則旨在指導(dǎo)和規(guī)范腦電圖機產(chǎn)品的注冊申報工作,幫助申請人理解和掌握該類產(chǎn)品的原理/機理、結(jié)構(gòu)、主要風險、性能、預(yù)期用途等內(nèi)容,用來指導(dǎo)申請人準備和撰寫申報資料。同時也可以用于幫助審評人員把握技術(shù)審評工作基本要求和尺度,對產(chǎn)品安全性、有效性做出系統(tǒng)評價。
本指導(dǎo)原則所確定的核心內(nèi)容是在目前的科技認知水平和現(xiàn)有產(chǎn)品技術(shù)基礎(chǔ)上形成的。因此,相關(guān)人員參考時應(yīng)注意其適宜性,密切關(guān)注適用標準及相關(guān)技術(shù)的最新進展,考慮產(chǎn)品的更新和變化。隨著對產(chǎn)品理解的不斷深入,本指導(dǎo)原則相關(guān)內(nèi)容也將適時進行調(diào)整。
本指導(dǎo)原則不作為法規(guī)強制執(zhí)行,如有能夠滿足法規(guī)要求的其他方法也可以采用,但應(yīng)提供詳細和充分的研究資料和驗證資料。應(yīng)在遵循相關(guān)法規(guī)的前提下使用本指導(dǎo)原則。
本指導(dǎo)原則適用于《醫(yī)療器械分類目錄》(以下簡稱《目錄》)中分類編碼為07-03-06,管理類別為Ⅱ類的腦電圖機產(chǎn)品。
本指導(dǎo)原則不適用于腦電地形圖儀、誘發(fā)電位產(chǎn)品及帶有誘發(fā)電位功能的腦電測量產(chǎn)品。
(一)監(jiān)管信息
1.應(yīng)按照《醫(yī)療器械注冊申報資料要求及說明》的要求提交申請表、術(shù)語、縮寫詞列表、產(chǎn)品列表、關(guān)聯(lián)文件、申報前與監(jiān)管機構(gòu)的聯(lián)系情況和溝通記錄(如適用)、符合性聲明等。
明確申請表中產(chǎn)品名稱、管理類別、分類編碼、型號規(guī)格、產(chǎn)品組成等信息。
2.注冊單元劃分的原則和實例
產(chǎn)品注冊單元劃分可參照《醫(yī)療器械注冊單元劃分指導(dǎo)原則》的要求,注冊單元劃分著重考慮產(chǎn)品的技術(shù)原理、結(jié)構(gòu)組成、性能指標及適用范圍等因素。
例如:技術(shù)原理相同,但產(chǎn)品主要結(jié)構(gòu)、組成的不同對安全有效性有影響的,原則上劃分為不同注冊單元。如腦電放大器和軟件組合形式的腦電圖機與集成式腦電圖機,應(yīng)劃分為不同注冊單元。
(二)綜述資料
1.概述
1.1產(chǎn)品名稱及確定依據(jù)
應(yīng)當描述申報產(chǎn)品的通用名稱及其確定依據(jù)。腦電圖機產(chǎn)品的命名應(yīng)采用《目錄》或國家標準、行業(yè)標準中的通用名稱,或以產(chǎn)品結(jié)構(gòu)和預(yù)期目的為依據(jù)命名,應(yīng)符合《醫(yī)用診察和監(jiān)護器械通用名稱命名指導(dǎo)原則》等相關(guān)法規(guī)的要求。
產(chǎn)品常用的名稱舉例如下:腦電圖機。
1.2產(chǎn)品管理類別
描述申報產(chǎn)品的管理類別,包括:所屬分類子目錄名稱、一級產(chǎn)品類別、二級產(chǎn)品類別,管理類別,分類編碼。
1.3適用范圍
描述申報產(chǎn)品的預(yù)期用途,并描述其適用的醫(yī)療階段(如治療后的監(jiān)測、康復(fù)等)。明確目標用戶及其操作或使用該產(chǎn)品應(yīng)當具備的技能/知識/培訓(xùn)。說明與其組合使用實現(xiàn)預(yù)期用途的其他產(chǎn)品。產(chǎn)品的適用范圍應(yīng)與申報產(chǎn)品的性能、功能相符,并應(yīng)與臨床評價資料結(jié)論一致。
例如產(chǎn)品的適用范圍為:該產(chǎn)品可采集和記錄患者的腦電信號,在醫(yī)療機構(gòu)中供培訓(xùn)合格的醫(yī)務(wù)人員使用,用于腦電圖的檢查。
如果有創(chuàng)新的臨床應(yīng)用,需要在產(chǎn)品適用范圍中描述。
2.產(chǎn)品描述
2.1器械及操作原理描述
2.1.1工作原理
腦電圖機是由測量腦電信號的生物電放大器,通過腦電傳感器采集人體頭部生物電信號,放大,濾波后,進行信號處理與分析和記錄。根據(jù)分析結(jié)果進行顯示、記錄和傳輸。
應(yīng)當描述產(chǎn)品的工作原理、主要功能及其組成部件的功能、產(chǎn)品圖示、區(qū)別于其他同類產(chǎn)品的特征等內(nèi)容。詳述腦電放大器結(jié)構(gòu)及軟件的功能。
2.1.2結(jié)構(gòu)組成
應(yīng)當明確申報產(chǎn)品的結(jié)構(gòu)和組成,腦電圖機通常由腦電放大器、腦電電極、腦電導(dǎo)聯(lián)線、顯示單元、主機及軟件等部分組成。若含有多個組成部分,應(yīng)說明其連接或組裝關(guān)系。如腦電放大器與主機之間的通訊介質(zhì)形式(有線、無線)。
2.2型號規(guī)格
提供產(chǎn)品各型號規(guī)格的劃分原則。對于存在多種型號、規(guī)格的產(chǎn)品,需明確各型號、規(guī)格的區(qū)別。需采用對比表及帶有說明性文字的圖片、圖表,對各種型號、規(guī)格的結(jié)構(gòu)組成、功能、產(chǎn)品特征和運行模式、技術(shù)參數(shù)等方面加以描述。
2.3包裝說明
說明所有產(chǎn)品組成的包裝信息。描述產(chǎn)品包裝的組成部分,對于每個組成部分,詳細描述包裝清單和包裝方式,并提供包裝圖示,如電極(或?qū)?lián)線)為外購有注冊證的產(chǎn)品,建議說明。
2.4研發(fā)歷程
闡述申請注冊產(chǎn)品的研發(fā)背景和目的。如有參考的同類產(chǎn)品或前代產(chǎn)品,需提供同類產(chǎn)品或前代產(chǎn)品的信息,并說明選擇其作為研發(fā)參考的原因。
2.5與同類和/或前代產(chǎn)品的參考和比較
列表比較說明申報產(chǎn)品與同類產(chǎn)品和/或前代產(chǎn)品在工作原理、結(jié)構(gòu)組成、制造材料、性能指標、以及適用范圍等方面的異同。
如適用,明確與申報產(chǎn)品聯(lián)合使用實現(xiàn)預(yù)期用途的其他產(chǎn)品的詳細信息。對于已獲得批準的部件或配合使用的附件(如一次性使用腦電電極),應(yīng)當提供注冊證編號和國家藥監(jiān)局官方網(wǎng)站公布的注冊證信息。
3.適用范圍和禁忌證
3.1適用范圍
描述申報產(chǎn)品的預(yù)期用途,并描述其適用的醫(yī)療階段(如治療后的監(jiān)測、康復(fù)等)。明確目標用戶及其操作或使用該產(chǎn)品應(yīng)當具備的技能/知識/培訓(xùn)。說明與其組合使用實現(xiàn)預(yù)期用途的其他產(chǎn)品。產(chǎn)品的適用范圍應(yīng)與申報產(chǎn)品的性能、功能相符,并應(yīng)與臨床評價資料結(jié)論一致。
例如:產(chǎn)品的適用范圍為:該產(chǎn)品可采集和記錄患者的腦電信號,在醫(yī)療機構(gòu)中供培訓(xùn)合格的醫(yī)務(wù)人員使用,用于腦電圖的檢查。
如果有創(chuàng)新的臨床應(yīng)用,需要在產(chǎn)品適用范圍中描述。
3.2預(yù)期使用環(huán)境
明確該產(chǎn)品預(yù)期使用的地點、可能影響其安全性和有效性的環(huán)境條件。應(yīng)明確對設(shè)備使用地點和使用環(huán)境的要求。舉例:適用于各級醫(yī)院神經(jīng)科、精神科,精神衛(wèi)生中心等。
3.3適用人群
應(yīng)當明確目標患者人群的信息。
3.4禁忌證
應(yīng)當明確說明該產(chǎn)品禁忌應(yīng)用的特定人群、疾病種類等。例如:皮膚破損、對腦電電極材質(zhì)過敏者禁止使用。
4.產(chǎn)品的不良事件歷史記錄
如適用,應(yīng)當提交申報產(chǎn)品的上市情況、不良事件和召回、銷售/不良事件及召回率等信息。注冊申請人應(yīng)關(guān)注和檢索不良事件,在風險分析時關(guān)注同品種醫(yī)療器械產(chǎn)品的不良事件歷史記錄。應(yīng)詳細闡述不良事件發(fā)生的情況,并根據(jù)不良事件的情形分類,分析不良事件發(fā)生的原因。
(三) 非臨床資料
1.產(chǎn)品風險管理資料
產(chǎn)品風險管理資料是對產(chǎn)品的風險管理過程及其評審的結(jié)果予以記錄所形成的資料。應(yīng)當提供下列內(nèi)容,并說明對于每項已判定危害的下列各個過程的可追溯性。
1.1風險分析:包括醫(yī)療器械適用范圍和與安全性有關(guān)特征的識別、危害的識別、估計每個危害處境的風險。
1.2風險評價:對于每個已識別的危害處境,評價和決定是否需要降低風險,若需要,描述如何進行相應(yīng)風險控制。
1.3風險控制:描述為降低風險所執(zhí)行風險控制的相關(guān)內(nèi)容。
1.4任何一個或多個剩余風險的可接受性評定。
1.5與產(chǎn)品受益相比,綜合評價產(chǎn)品風險可接受。
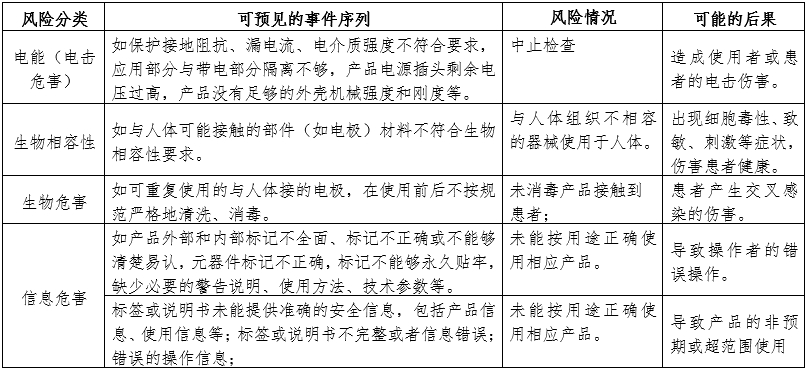
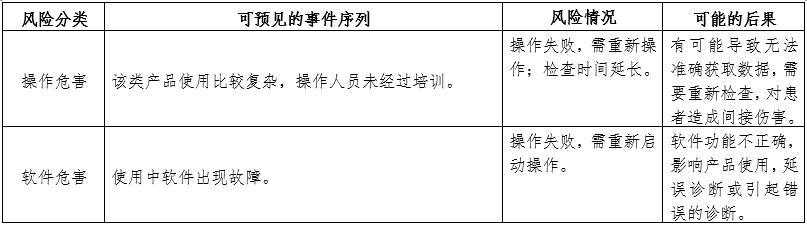
附表中是腦電圖機常見的主要風險。由于腦電圖機功能和結(jié)構(gòu)的差異,本章給出的主要風險及其示例是常見的而不是全部的。上述部分只是風險管理過程的組成部分,不是風險管理的全部。申請人應(yīng)按照GB/T 42062中規(guī)定的過程和方法,在產(chǎn)品整個生命周期內(nèi)建立、形成文件和保持一個持續(xù)的過程,用以判定與醫(yī)療器械有關(guān)的危險、估計和評價相關(guān)的風險、控制這些風險并監(jiān)視上述控制的有效性,以充分保證產(chǎn)品的安全和有效。
2.醫(yī)療器械安全和性能基本原則清單
應(yīng)按照《醫(yī)療器械注冊申報資料要求及說明》的要求提交《醫(yī)療器械安全和性能基本原則清單》,說明產(chǎn)品符合《醫(yī)療器械安全和性能基本原則清單》各項適用要求所采用的方法,以及證明其符合性的文件。對于《醫(yī)療器械安全和性能基本原則清單》中不適用的各項要求,需說明理由。
對于包含在產(chǎn)品注冊申報資料中的文件,應(yīng)當說明其在申報資料中的具體位置;對于未包含在產(chǎn)品注冊申報資料中的文件,應(yīng)當注明該證據(jù)文件名稱及其在質(zhì)量管理體系文件中的編號備查。
3.產(chǎn)品技術(shù)要求
申請人依據(jù)《醫(yī)療器械產(chǎn)品技術(shù)要求編寫指導(dǎo)原則》的要求編寫產(chǎn)品技術(shù)要求。
產(chǎn)品電氣安全性能、電磁兼容、主要技術(shù)性能應(yīng)當執(zhí)行國家和行業(yè)的強制性標準;性能指標應(yīng)當能滿足產(chǎn)品的安全有效性。
醫(yī)療器械產(chǎn)品技術(shù)要求應(yīng)采用規(guī)范、通用的術(shù)語,符合工程技術(shù)、臨床醫(yī)學等方面的專業(yè)標準及規(guī)范。對于標準中已經(jīng)列明的術(shù)語原則上不應(yīng)修改或另行制定,對于標準中未列明的術(shù)語應(yīng)當在產(chǎn)品技術(shù)要求列明并釋義。
3.1產(chǎn)品型號/規(guī)格
應(yīng)參照綜述資料中規(guī)格型號部分的要求列明。包含但不限于:
3.1.1申報產(chǎn)品主機的規(guī)格型號和劃分說明(如適用)。
3.1.2載明通道數(shù)
3.1.3軟件的名稱、型號規(guī)格(若適用)、發(fā)布版本、版本命名規(guī)則。
3.2性能指標
3.2.1性能要求包括但不限于如下條款
3.2.1.1定標電壓誤差要求
3.2.1.2電壓測量誤差要求
3.2.1.3時間間隔誤差要求
3.2.1.4時間常數(shù)及誤差要求
3.2.2.5幅頻特性及誤差要求
3.2.2.6噪聲電平
3.2.2.7共模抑制比
3.2.2.8耐極化電壓
3.2.2.9靈敏度
3.2.2.10低通濾波
3.2.2.11輸入阻抗
3.2.2.12腦電電極要求(若適用)
腦電電極應(yīng)考慮標記,性能和安全等相關(guān)要求。申請人可根據(jù)產(chǎn)品的結(jié)構(gòu)組成和工藝特點進行規(guī)定,主要包括電性能、粘合性能、連接性能、微生物性能等。
3.2.3軟件功能部分
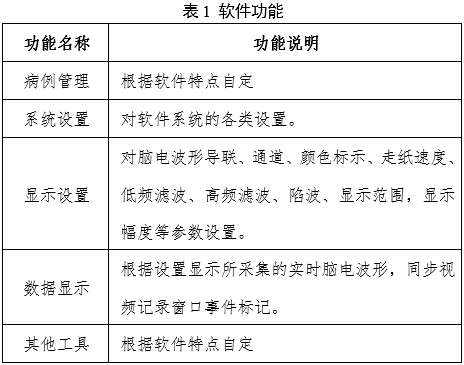
應(yīng)滿足腦電圖機的數(shù)據(jù)采集、存儲、系統(tǒng)設(shè)置、打印等功能,一般軟件功能如表1。
3.3電氣安全
應(yīng)符合GB 9706.1《醫(yī)用電氣設(shè)備 第1部分:基本安全和基本性能的通用要求》、GB 9706.226《醫(yī)用電氣設(shè)備 第2-26部分:腦電圖機的基本安全和基本性能專用要求》。
3.4電磁兼容性
應(yīng)符合YY9706.102《醫(yī)用電氣設(shè)備 第1-2部分:基本安全和基本性能的通用要求 并列標準:電磁兼容 要求和試驗》、GB 9706.226《醫(yī)用電氣設(shè)備 第2-26部分:腦電圖機的基本安全和基本性能專用要求》的相關(guān)要求。
4.檢驗報告
注冊申請人應(yīng)提供產(chǎn)品檢驗報告,檢驗報告可以是申請人出具的自檢報告,也可以是委托有資質(zhì)的醫(yī)療器械檢驗機構(gòu)出具的檢驗報告。
同一注冊單元內(nèi)所檢驗的產(chǎn)品應(yīng)當是能夠代表本注冊單元內(nèi)其他產(chǎn)品安全性和有效性的典型產(chǎn)品。若申報的產(chǎn)品包括多個型號規(guī)格,在電氣安全(含電磁兼容)的檢驗中,原則上選取結(jié)構(gòu)最復(fù)雜、功能最多、配置最齊全的型號規(guī)格進行檢驗。如包括不同通道數(shù)的放大器部件,原則上選擇通道數(shù)最多的型號規(guī)格進行檢測。
產(chǎn)品注冊檢測應(yīng)按產(chǎn)品配置進行,檢測報告應(yīng)注明產(chǎn)品配置,應(yīng)提供軟件發(fā)布版本及軟件完整版本照片。若適用,提供檢測報告清單,明確各檢測報告對應(yīng)的檢測配置及檢測類型。
檢驗報告所附照片中的產(chǎn)品結(jié)構(gòu)組成、標識標簽等信息應(yīng)當與其他申報資料描述相同。
5.研究資料
至少應(yīng)包含以下內(nèi)容。
5.1產(chǎn)品性能研究
應(yīng)提供性能指標及試驗方法的制定依據(jù)。應(yīng)符合的國家標準、行業(yè)標準,給出其中性能指標不適用項說明。應(yīng)提供產(chǎn)品技術(shù)要求中條款的注冊申請人檢驗方法的制定依據(jù)。必要時提供文獻等。
產(chǎn)品適用的相關(guān)標準如表2所示。
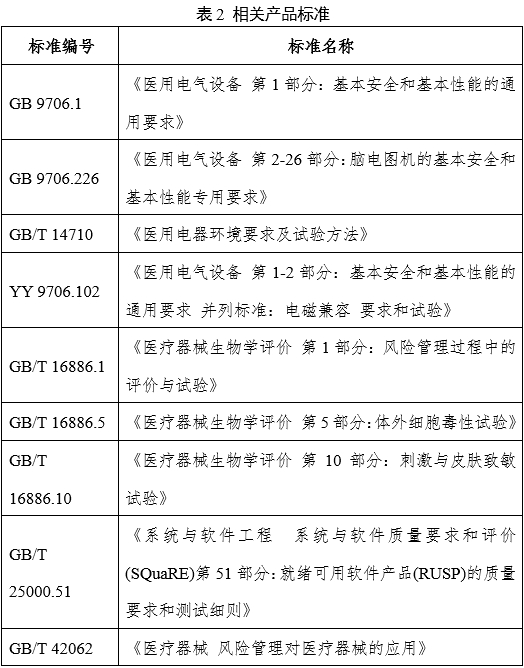
上述標準包括了產(chǎn)品技術(shù)要求中可能涉及到的標準,申請人可以根據(jù)申報產(chǎn)品特征進行分析,確定引用標準;不包括根據(jù)產(chǎn)品的特點所引用的一些行業(yè)外標準或其他標準。上述標準如有新版發(fā)布實施,應(yīng)執(zhí)行最新版本。
5.2生物相容性評價研究
腦電圖機配套使用的腦電電極需直接接觸患者皮膚,因此需進行生物相容性評價。生物相容性評價研究資料應(yīng)當包括:生物相容性評價的依據(jù)和方法,產(chǎn)品所用材料的描述及與人體接觸的性質(zhì),實施或豁免生物學試驗的理由和論證,對于現(xiàn)有數(shù)據(jù)或試驗結(jié)果的評價,評價根據(jù)GB/T 16886.1《醫(yī)療器械生物學評價 第1部分:風險管理過程中的評價與試驗》標準進行。
5.3使用期限和包裝驗證研究
使用期限參考《有源醫(yī)療器械使用期限注冊技術(shù)審查指導(dǎo)原則》,申請人應(yīng)基于風險評估及可靠性測試提供整機使用期限評估資料。
若依據(jù)分析關(guān)鍵部件壽命來確定產(chǎn)品使用期限,關(guān)鍵部件包括但不限于顯示屏、電源模塊等。產(chǎn)品若具有可更換部件,應(yīng)明確定期保養(yǎng)維護時間和更換頻次,且應(yīng)給出支持性資料。
申請人應(yīng)提供在宣稱的運輸、儲存條件下產(chǎn)品的包裝驗證資料。注冊申請人需提交包裝研究資料,對包裝進行分析研究和評價。包裝驗證的資料內(nèi)容應(yīng)與包裝說明中給出的信息相符。
參考GB/T14710-2009提供環(huán)境試驗測試報告。
5.4軟件及網(wǎng)絡(luò)安全研究
該產(chǎn)品一般均含有軟件,注冊申請人應(yīng)依據(jù)《醫(yī)療器械軟件注冊審查指導(dǎo)原則》的要求,提交自研軟件研究報告、外部軟件環(huán)境評估報告(若適用)以及GB/T 25000.51自測報告(亦可提交自檢報告或檢驗報告代替自測報告)。若使用現(xiàn)成軟件組件,根據(jù)其使用方式提交相應(yīng)研究資料。
如產(chǎn)品具備電子數(shù)據(jù)交換、遠程訪問與控制、用戶訪問等功能,注冊申請人應(yīng)依據(jù)《醫(yī)療器械網(wǎng)絡(luò)安全注冊審查指導(dǎo)原則》的要求,在軟件研究資料中單獨提交自研軟件網(wǎng)絡(luò)安全研究報告。若使用現(xiàn)成軟件組件,根據(jù)其使用方式提交相應(yīng)研究資料。
(四)臨床評價資料
依據(jù)國家藥品監(jiān)督管理局公布的《免于臨床評價醫(yī)療器械目錄》,腦電圖機屬于《免于臨床評價醫(yī)療器械目錄》中產(chǎn)品,可免于臨床評價。按照《列入免于進行臨床評價醫(yī)療器械目錄產(chǎn)品對比說明技術(shù)指導(dǎo)原則》提交相關(guān)資料,從基本原理、結(jié)構(gòu)組成、性能、安全性、適用范圍等方面,證明產(chǎn)品的安全有效性。
(五)產(chǎn)品說明書和標簽樣稿
1.通用要求
產(chǎn)品的標志、標簽和使用說明書應(yīng)符合《醫(yī)療器械說明書和標簽管理規(guī)定》的規(guī)定和YY/T 0466.1《醫(yī)療器械 用于醫(yī)療器械標簽、標記和提供信息的符號 第1部分:通用要求》的要求。
說明書中必須告知用戶的信息應(yīng)當完整,如應(yīng)明確本產(chǎn)品預(yù)期使用的環(huán)境、適用人群和限制使用的情況;應(yīng)明確產(chǎn)品一次性使用附件的使用注意事項等
2.使用說明書
建議在使用說明書中明確下列內(nèi)容:
2.1對操作人員的要求。
2.2腦電電極的安放方法,導(dǎo)聯(lián)線的顏色說明和連接方法。
2.3如有重復(fù)使用電極,應(yīng)給出重復(fù)使用電極的消毒,清潔和保存方法。
2.4應(yīng)當在說明書中標明的其他內(nèi)容(如有)。
2.5導(dǎo)聯(lián)線的重復(fù)使用及故障、更換周期等要求。
(六)質(zhì)量管理體系文件
按照《關(guān)于公布醫(yī)療器械注冊申報資料要求和批準證明文件格式的公告》的要求提交質(zhì)量管理體系文件。
[1] GB 9706.1-2020,醫(yī)用電氣設(shè)備 第1部分:基本安全和基本性能的通用要求[S].
[2] GB 9706.226-2021,醫(yī)用電氣設(shè)備 第2-26部分:腦電圖機的基本安全和基本性能專用要求[S].
[3] JJF 1388-2013,數(shù)字腦電圖機及腦電地形圖儀型式評價大綱[S].
[4] JJG 954-2000,數(shù)字腦電圖儀及腦電地形圖儀[S].
[5] GB/T 14710-2009,醫(yī)用電器設(shè)備環(huán)境要求及試驗方法[S].
[6] GB/T 16886.1-2022,醫(yī)療器械生物學評價 第1部分:風險管理過程中的評價與試驗[S].
[7] GB/T 16886.5-2017,醫(yī)療器械生物學評價 第5部分:體外細胞毒性試驗[S].
[8] GB/T 16886.10-2017,醫(yī)療器械生物學評價 第10部分:刺激與遲發(fā)型超敏反應(yīng)試驗[S].
[9] GB/T 25000.51-2016,系統(tǒng)與軟件工程 系統(tǒng)與軟件質(zhì)量要求和評價(SQuaRE) 第51部分:就緒可用軟件(RUSP)的質(zhì)量要求和測試細則[S].
[10] YY 9706.102, 醫(yī)用電氣設(shè)備 第1-2部分:基本安全和基本性能的通用要求 并列標準:電磁兼容 要求和試驗[S].
[11] GB/T 42062-2022,醫(yī)療器械風險管理對醫(yī)療器械的應(yīng)用[S].
[12]國家食品藥品監(jiān)督管理局.移動醫(yī)療器械注冊技術(shù)審查指導(dǎo)原則:總局通告2017年第222號[Z].
[13]國家藥品監(jiān)督管理局醫(yī)療器械審評中心.醫(yī)療器械網(wǎng)絡(luò)安全注冊審查指導(dǎo)原則(2022年修訂版):國家藥監(jiān)局器審中心通告2022年第7號[Z]
[14]北京市藥品監(jiān)督管理局.腦電圖機產(chǎn)品技術(shù)審評規(guī)范: 京藥監(jiān)發(fā)〔2019〕163號[Z].
[15]國家藥品監(jiān)督管理局醫(yī)療器械審評中心.一次性使用腦電電極注冊審查指導(dǎo)原則:國家藥監(jiān)局器審中心通告2022年第35號[Z]
[16]國家食品藥品監(jiān)督管理局.醫(yī)療器械注冊單元劃分指導(dǎo)原則:總局通告2017年第187號[Z].
[17]國家藥品監(jiān)督管理局醫(yī)療器械審評中心.醫(yī)療器械軟件注冊審查指導(dǎo)原則(2022年修訂版):國家藥監(jiān)局器審中心通告2022年第9號[Z].
[18]國家藥品監(jiān)督管理局.醫(yī)療器械產(chǎn)品技術(shù)要求編寫指導(dǎo)原則:國家藥監(jiān)局公告2022年第8號[Z].
附表

站點聲明
本網(wǎng)站所提供的信息僅供參考之用,并不代表本網(wǎng)贊同其觀點,也不代表本網(wǎng)對其真實性負責。圖片版權(quán)歸原作者所有,如有侵權(quán)請聯(lián)系我們,我們立刻刪除。如有關(guān)于作品內(nèi)容、版權(quán)或其它問題請于作品發(fā)表后的30日內(nèi)與本站聯(lián)系,本網(wǎng)將迅速給您回應(yīng)并做相關(guān)處理。
鄭州思途醫(yī)療科技有限公司專注于醫(yī)療器械產(chǎn)品政策與法規(guī)規(guī)事務(wù)服務(wù),提供產(chǎn)品注冊備案申報代理、臨床試驗、體系建立輔導(dǎo)、分類界定、申請創(chuàng)新辦理服務(wù)。

為深入貫徹落實中共中央辦公廳、國務(wù)院辦公廳印發(fā)的《關(guān)于深化審評審批制度改革鼓勵藥品醫(yī)療器械創(chuàng)新的意見》(廳字〔2017〕42號),按照國家藥品監(jiān)督管理局《關(guān)于擴大醫(yī)療器械

為規(guī)范醫(yī)療器械注冊人跨區(qū)域委托生產(chǎn)的監(jiān)督管理,推進長江三角洲區(qū)域醫(yī)療器械跨區(qū)域監(jiān)管,根據(jù)《中共中央辦公廳國務(wù)院辦公廳關(guān)于深化審評審批制度改革鼓勵藥品醫(yī)療器械創(chuàng)新的意見》《

2024年10月19日,在第 75 屆世界醫(yī)學會全體大會上正式通過了《赫爾辛基宣言》的最新修訂版本;《赫爾辛基宣言》作為人類參與者的醫(yī)學研究倫理

附件:血液透析用水處理設(shè)備注冊審查指導(dǎo)原則(2024年修訂版)(2024年第19號).doc血液透析用水處理設(shè)備注冊審查指導(dǎo)原則(2024年修訂版)本指導(dǎo)原則旨在指導(dǎo)注冊申請人對血液透析用水處理設(shè)備注冊申報資料的準備及撰寫,同時也為技術(shù)審評部門提供參考。本指導(dǎo)原則是對血液透析用水處理設(shè)備的一般要求,注冊申請人依據(jù)產(chǎn)品的具體特性確定其中內(nèi)容是否適用。若不適用,要具體闡述理由及相應(yīng)的科學依據(jù),并依據(jù)產(chǎn)

本指導(dǎo)原則旨在幫助和指導(dǎo)注冊申請人對一次性使用腹部穿刺器注冊申報資料進行準備,以滿足技術(shù)審評的基本要求。同時有助于審評機構(gòu)對該類產(chǎn)品進行科學規(guī)范的審評,提高審評工

國家藥監(jiān)局關(guān)于發(fā)布免于臨床試驗的體外診斷試劑臨床評價技術(shù)指導(dǎo)原則的通告(2021年第74號)發(fā)布時間:2021-09-24為指導(dǎo)體外診斷試劑的臨床評價工作,根據(jù)

國家藥監(jiān)局藥審中心關(guān)于發(fā)布《抗腫瘤藥物臨床試驗中SUSAR分析與處理技術(shù)指導(dǎo)原則》的通告(2024年第42號) 發(fā)布日期:20241010

附件:重組膠原蛋白創(chuàng)面敷料注冊審查指導(dǎo)原則(2023年第16號).doc重組膠原蛋白創(chuàng)面敷料注冊審查指導(dǎo)原則本指導(dǎo)原則旨在指導(dǎo)注冊申請人準備及撰寫重組膠原蛋白創(chuàng)

附件:醫(yī)用透明質(zhì)酸鈉創(chuàng)面敷料注冊審查指導(dǎo)原則(2024年第21號).doc醫(yī)用透明質(zhì)酸鈉創(chuàng)面敷料注冊審查指導(dǎo)原則本指導(dǎo)原則旨在指導(dǎo)注冊申請人準備及撰寫醫(yī)用透明質(zhì)酸鈉創(chuàng)面敷料注冊申報資料,同時也為技術(shù)審評部門審查注冊申報資料提供參考。本指導(dǎo)原則是對醫(yī)用透明質(zhì)酸鈉創(chuàng)面敷料產(chǎn)品的一般要求,注冊申請人應(yīng)依據(jù)產(chǎn)品的具體特性確定其中內(nèi)容是否適用,若不適用,需具體闡述理由及相應(yīng)的科學依據(jù),并依據(jù)產(chǎn)品的具體特性對

國家藥監(jiān)局器審中心關(guān)于發(fā)布影像型超聲診斷設(shè)備(第三類)注冊審查指導(dǎo)原則(2023年修訂版)的通告(2024年第29號)發(fā)布時間:2024-10-14為進一步規(guī)范
行業(yè)資訊
?
?
?
?
?
?
知識分享
法規(guī)文件
?
?
?
?
?
?
八年
醫(yī)療器械服務(wù)經(jīng)驗
聯(lián)系思途,免費獲得專屬《落地解決方案》及報價
咨詢相關(guān)問題或咨詢報價,可以直接與我們聯(lián)系
思途CRO——醫(yī)療器械注冊臨床第三方平臺
