哪些體外診斷試劑IVD產(chǎn)品不需要做臨床試驗(yàn)?
經(jīng)常有朋友問什么產(chǎn)品無需進(jìn)行臨床試驗(yàn)?小編就在這簡單的說一下關(guān)于體外診斷試劑注冊的免臨床和臨床評價(jià)。如果有什么不對的地方或者漏缺的,麻煩大家多多留言共同探討!"


注冊備案 · 臨床試驗(yàn) · 體系建立輔導(dǎo) · 分類界定 · 申請創(chuàng)新
來源:醫(yī)療器械注冊代辦 發(fā)布日期:2025-08-02 閱讀量:次
體外診斷試劑(IVD)的說明書是指導(dǎo)用戶正確使用產(chǎn)品、獲取準(zhǔn)確結(jié)果的關(guān)鍵技術(shù)文件。其中,關(guān)于適用儀器參數(shù)配置的描述尤為重要,它直接關(guān)系到檢測能否順利執(zhí)行以及結(jié)果的可靠性。很多用戶拿到試劑后,最關(guān)心的就是“這試劑該在儀器上怎么設(shè)置?”說明書如果寫得含糊不清,用戶就得反復(fù)摸索或者聯(lián)系廠家,既耽誤時(shí)間又可能出錯。所以,這部分內(nèi)容怎么寫,咱們得好好聊聊。

說明書不能光寫個(gè)儀器型號就完事了。對于全自動儀器尤其如此。需要把儀器運(yùn)行中與本次檢測直接相關(guān)的關(guān)鍵參數(shù)具體值或允許范圍清晰列出來。
1.哪些是關(guān)鍵參數(shù)?這要看檢測原理和方法學(xué)。比如,對于依賴比色或熒光的ELISA試劑,孵育溫度(如37±0.5°C)、孵育時(shí)間(如30±1分鐘)、震蕩模式(如線性震蕩、軌道震蕩)和頻率、讀板波長(如450nm主波長,630nm參比波長)就是關(guān)鍵。對于PCR試劑,循環(huán)參數(shù)(變性、退火、延伸的溫度和時(shí)間)、熒光通道選擇、閾值設(shè)定方式(手動/自動)就是核心。對于生化試劑,反應(yīng)溫度、主副波長、反應(yīng)監(jiān)測點(diǎn)(讀點(diǎn)時(shí)間)、樣本/試劑體積比、攪拌參數(shù)等必不可少。
2.如何描述?應(yīng)給出具體的數(shù)值或范圍。避免使用模糊詞匯,如“適當(dāng)溫度”、“常規(guī)時(shí)間”。正確的寫法是:“孵育溫度:37.0 ± 0.5 °C”, “讀板波長:主波長 450 nm,參比波長 630 nm”, “反應(yīng)溫度:37 °C”, “樣本體積:3 μL,試劑1體積:240 μL,試劑2體積:80 μL”。如果某個(gè)參數(shù)在儀器上有多種可選模式,應(yīng)明確指定本次檢測應(yīng)使用的模式,例如:“攪拌模式:使用標(biāo)準(zhǔn)正向攪拌(Standard CW Mixing)”。
3.為什么重要?這些參數(shù)直接影響反應(yīng)動力學(xué)、信號產(chǎn)生和檢測精度。不同的設(shè)定可能導(dǎo)致結(jié)果偏高、偏低或精密度變差。明確寫出來,用戶才能正確設(shè)置,保證不同實(shí)驗(yàn)室、不同操作者之間結(jié)果的一致性。
很多全自動儀器功能復(fù)雜,有多種運(yùn)行模塊或程序選項(xiàng)。說明書需要指明完成本次檢測所需的特定操作模式或程序名稱。
1.具體描述操作流程:雖然不需要像儀器說明書那樣詳細(xì)到每個(gè)按鍵,但應(yīng)清晰描述在儀器上啟動和運(yùn)行該檢測的基本流程。例如:“在[儀器名稱]主菜單選擇‘免疫分析’模塊 -> 選擇‘酶聯(lián)免疫吸附試驗(yàn)(ELISA)’程序 -> 在程序列表中選擇‘[本試劑名稱]’測試項(xiàng)目或輸入以下參數(shù)…”。如果儀器需要加載特定的測試協(xié)議(Test Protocol)或應(yīng)用文件(Application File),應(yīng)明確告知用戶需要加載哪個(gè)文件(通常由制造商提供)。
2.與參數(shù)結(jié)合:這個(gè)模式描述通常與前面提到的關(guān)鍵參數(shù)是關(guān)聯(lián)的。選擇了正確的程序或模式,其內(nèi)置的默認(rèn)參數(shù)就應(yīng)符合試劑要求。但即使如此,關(guān)鍵參數(shù)的具體值在試劑說明書中單獨(dú)列出仍是必要的雙重確認(rèn)和便捷參考。
儀器參數(shù)設(shè)置相關(guān)的特殊要求或限制,應(yīng)放在“注意事項(xiàng)”部分醒目提示。
1.校準(zhǔn)與質(zhì)控:明確儀器是否需要在使用本試劑前進(jìn)行校準(zhǔn),以及應(yīng)使用哪種校準(zhǔn)品和校準(zhǔn)程序。同時(shí),應(yīng)規(guī)定質(zhì)控測試的頻率和要求,例如:“每次運(yùn)行前或每24小時(shí),或按實(shí)驗(yàn)室質(zhì)控程序要求,使用配套質(zhì)控品進(jìn)行質(zhì)控測試”。強(qiáng)調(diào)校準(zhǔn)和質(zhì)控對于結(jié)果準(zhǔn)確性的重要性。
2.儀器維護(hù):指明與本試劑檢測性能相關(guān)的關(guān)鍵儀器維護(hù)要求,特別是那些容易被忽視但影響重大的項(xiàng)目。例如:“確保比色杯清潔度符合要求,定期執(zhí)行儀器光學(xué)檢查(Photometer Check)”,“定期清潔樣本針、試劑針、攪拌針,防止交叉污染和加樣不準(zhǔn)”,“確保恒溫系統(tǒng)溫度準(zhǔn)確性和穩(wěn)定性”。
3.干擾與兼容性:提醒用戶注意儀器狀態(tài)或環(huán)境因素可能對檢測造成的干擾。例如:“避免在強(qiáng)電磁干擾源附近放置儀器”,“確保儀器接地良好”,“儀器散熱口保持通暢”。如果試劑對儀器的某些通用設(shè)置(如某些清洗液、通用耗材)有特殊兼容性要求或限制,也需在此說明。
4.軟件版本:如果試劑對儀器操作系統(tǒng)或特定分析模塊的軟件版本有要求(例如需要最低版本或特定版本),必須明確說明:“本試劑要求[儀器名稱]操作系統(tǒng)版本不低于vX.X.X”或“需使用配套提供的專用分析軟件版本vY.Y.Y”。軟件版本不匹配是導(dǎo)致檢測失敗的常見原因之一。
如果儀器參數(shù)的設(shè)置直接影響性能指標(biāo)(如精密度、準(zhǔn)確度)的聲稱,或者結(jié)果需要儀器軟件進(jìn)行特定計(jì)算,應(yīng)在相關(guān)部分說明。
1.性能聲明基礎(chǔ):在“產(chǎn)品性能指標(biāo)”部分,可以注明:“本產(chǎn)品聲稱的精密度、準(zhǔn)確度等性能指標(biāo),是在符合本說明書規(guī)定的[儀器名稱]及上述參數(shù)配置下測試獲得。”
2.結(jié)果計(jì)算:如果儀器軟件需要執(zhí)行特定的計(jì)算邏輯(例如,計(jì)算酶活性、濃度值、Cut-off值等),應(yīng)簡要說明計(jì)算依據(jù)或公式(如果對用戶透明且有幫助),或至少指明“結(jié)果由儀器軟件根據(jù)預(yù)設(shè)算法自動計(jì)算得出”。如果用戶需要手動計(jì)算,應(yīng)提供詳細(xì)公式和示例。
1.圖表輔助:在描述儀器設(shè)置流程或關(guān)鍵組件位置(如樣本/試劑放置位置)時(shí),適當(dāng)加入流程圖、示意圖或儀器面板截圖(需清晰標(biāo)注),能極大提升用戶的理解速度和操作準(zhǔn)確性。
2.術(shù)語準(zhǔn)確:使用儀器制造商通用的、標(biāo)準(zhǔn)化的術(shù)語來描述參數(shù)和功能,避免使用可能引起歧義的內(nèi)部或非通用詞匯。
3.版本對應(yīng):確保說明書中描述的儀器型號、軟件版本、參數(shù)設(shè)置與試劑盒配套提供的儀器應(yīng)用文件或協(xié)議完全一致。當(dāng)儀器固件或軟件升級時(shí),試劑說明書可能需要相應(yīng)更新。
編寫IVD試劑說明書中的儀器參數(shù)配置部分,核心在于具體、明確、可操作。目的是讓用戶,即使是沒有太多經(jīng)驗(yàn)的操作者,也能根據(jù)說明書獨(dú)立、正確地完成儀器設(shè)置,無需反復(fù)查閱儀器手冊或咨詢廠商。要牢牢記住,體外診斷試劑說明書中【檢驗(yàn)方法】應(yīng)對檢測過程、主要步驟及反應(yīng)體系的關(guān)鍵參數(shù)進(jìn)行明確。對于適用儀器為全自動的,也應(yīng)明確適用儀器中與檢測相關(guān)的運(yùn)行模式、關(guān)鍵參數(shù)等設(shè)置,不建議僅以“具體操作步驟及參數(shù)設(shè)置見儀器說明書”等字樣進(jìn)行描述。 清晰詳盡的儀器參數(shù)描述,是保證檢測結(jié)果可靠性、可比性和試劑使用安全有效的重要基石。

站點(diǎn)聲明
本網(wǎng)站所提供的信息僅供參考之用,并不代表本網(wǎng)贊同其觀點(diǎn),也不代表本網(wǎng)對其真實(shí)性負(fù)責(zé)。圖片版權(quán)歸原作者所有,如有侵權(quán)請聯(lián)系我們,我們立刻刪除。如有關(guān)于作品內(nèi)容、版權(quán)或其它問題請于作品發(fā)表后的30日內(nèi)與本站聯(lián)系,本網(wǎng)將迅速給您回應(yīng)并做相關(guān)處理。
鄭州思途醫(yī)療科技有限公司專注于醫(yī)療器械產(chǎn)品政策與法規(guī)規(guī)事務(wù)服務(wù),提供產(chǎn)品注冊備案申報(bào)代理、臨床試驗(yàn)、體系建立輔導(dǎo)、分類界定、申請創(chuàng)新辦理服務(wù)。

經(jīng)常有朋友問什么產(chǎn)品無需進(jìn)行臨床試驗(yàn)?小編就在這簡單的說一下關(guān)于體外診斷試劑注冊的免臨床和臨床評價(jià)。如果有什么不對的地方或者漏缺的,麻煩大家多多留言共同探討!"

醫(yī)療器械說明書是醫(yī)療器械注冊時(shí)需要提交的資料之一,也是開展醫(yī)療器械經(jīng)營備案、或醫(yī)療器械經(jīng)營許可企業(yè)要重點(diǎn)關(guān)注的產(chǎn)品相關(guān)資料之一。一起來認(rèn)識醫(yī)療器械說明書相關(guān)事項(xiàng)。

2021年來了,讓我們一起來看看哪些公告機(jī)構(gòu)在2020年獲得了MDR/IVDR的資質(zhì),你所中意的機(jī)構(gòu)是否在名單中。原本歐盟醫(yī)療器械法規(guī)的過渡期到2020年5月就結(jié)束了,因?yàn)槿蛞咔榈脑颍?/p>
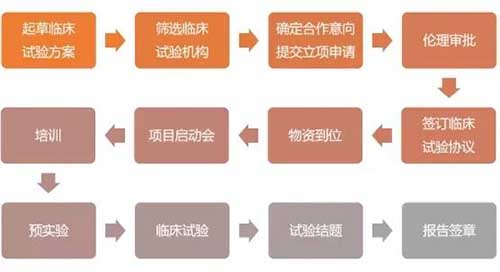
新冠肺炎疫情發(fā)生以來,相關(guān)藥械企業(yè)為滿足診斷需求,加速研發(fā)生產(chǎn)新冠肺炎診斷產(chǎn)品;特別是作為確診新冠肺炎的主要產(chǎn)品——體外診斷試劑,國家藥監(jiān)部門對其注冊申請啟動了應(yīng)

醫(yī)療器械說明書是醫(yī)療器械注冊申報(bào)資料中重要一項(xiàng),醫(yī)療器械說明書既要符合法規(guī)要求、產(chǎn)品特性,又要傾聽市場的聲音。因此,編寫醫(yī)療器械說明書是對注冊人員能力和大局觀要求較高的工

體外診斷試劑是指可單獨(dú)使用或與儀器、器具、設(shè)備或系統(tǒng)組合使用,在疾病的預(yù)防治療監(jiān)測、預(yù)后觀察、健康狀態(tài)評價(jià)以及遺傳性疾病的預(yù)測過程中,用于對人體樣本(各種體液、細(xì)

體外診斷試劑是臨床疾病預(yù)測、預(yù)防、診斷、治療監(jiān)測、預(yù)后觀察和健康狀態(tài)評價(jià)的重要手段,是臨床醫(yī)學(xué)研究的重要基礎(chǔ),現(xiàn)代檢驗(yàn)醫(yī)學(xué)重要的組成部分。體外診斷試劑應(yīng)用于臨床、
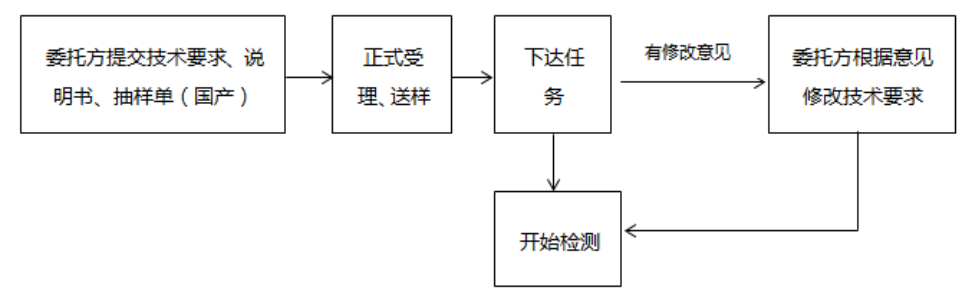
今年3月14日,北檢所公布體外診斷試劑注冊檢驗(yàn)送檢要求的公告,對承檢范圍、公告適用范圍、流程、資料準(zhǔn)備及樣品準(zhǔn)備,提出具體要求。

前段時(shí)間咨詢歐盟CE辦理的真不少,最近才閑下來,才有時(shí)間寫一篇關(guān)于醫(yī)療器械CE認(rèn)證方面的知識,本篇為大家科普有關(guān)IVDR分類的相關(guān)內(nèi)容。

體外診斷試劑臨床試驗(yàn)中對產(chǎn)品說明書的關(guān)注點(diǎn)有哪些?體外診斷試劑臨床試驗(yàn)設(shè)計(jì)和執(zhí)行過程中,應(yīng)特別關(guān)注臨床試驗(yàn)過程中的操作細(xì)節(jié)與相關(guān)產(chǎn)品說明書的一致性,其中涉及的說明
行業(yè)資訊
知識分享
法規(guī)文件
?
?
?
?
?
?
八年
醫(yī)療器械服務(wù)經(jīng)驗(yàn)
聯(lián)系思途,免費(fèi)獲得專屬《落地解決方案》及報(bào)價(jià)
咨詢相關(guān)問題或咨詢報(bào)價(jià),可以直接與我們聯(lián)系
思途CRO——醫(yī)療器械注冊臨床第三方平臺
