臨床試驗中的單盲、雙盲、三盲、破盲是什么意思?
盲法試驗常用的有兩種:單盲(single blinding)和雙盲(double blinding),更嚴格的對照試驗要用到三盲(triple blinding),在對照藥物和試驗藥物劑型或外觀不同時,還要用到雙盲雙模擬技


注冊備案 · 臨床試驗 · 體系建立輔導(dǎo) · 分類界定 · 申請創(chuàng)新
來源:醫(yī)療器械注冊代辦 發(fā)布日期:2023-10-10 閱讀量:次
?
醫(yī)學(xué)的進步是以研究為基礎(chǔ)的,這些研究在一定程度上賴于以人作為受試者的試驗。--《赫爾辛基宣言》
本期的重點,我們來說說Ⅰ期臨床試驗的點點滴滴。首先了解一下什么是Ⅰ期臨床研究?
Ⅰ期臨床研究定義:新藥試驗的起始期,包括耐受性試驗、藥代動力學(xué)研究、藥物相互作用、各種影響因素等。目的是確定可用于臨床新藥的安全有效劑量與合理給藥方案。根據(jù)藥物類別不同,Ⅰ期臨床研究的內(nèi)容不同。必須在SFDA規(guī)定的國家藥品臨床研究機構(gòu)(Ⅰ期)進行。
新藥臨床研究的起始階段,選擇一定數(shù)量的受試人數(shù),要求必須身體健康且初始劑量需從絕對安全范圍開始。目的在于: 1) 考察人體對該藥的耐受性; 2) 了解ADME; 3) 確定臨床試驗的安全劑量; 4) 確定合理給藥方案; 5) 其他:依研究內(nèi)容而定。

主要研究藥物特點,包括它的耐受性(需要多次驗證,單劑、多次研究)和藥代。
藥代包括一般藥代(也需要進行多次驗證,單劑、多次研究),需要充分考慮影響因素,主要有性別、人群、吸收、分布、代謝(代謝途徑、代謝產(chǎn)物、代謝產(chǎn)物活性、毒性,代謝產(chǎn)物的定量分析和物料平衡)、排泄等,如果是群體藥代還應(yīng)分別統(tǒng)計各年齡段(老年、青年、少年等),特殊人體藥代(考慮肝腎功能受損情況)及患者藥代。
其次,包括PK/PD(臨床抗菌藥物是否合理),心臟QT間期影響,血生化影響,免疫系統(tǒng)影響,藥物相互作用等等,都是新藥Ⅰ期臨床研究的研究內(nèi)容。
第一階段(開始人體暴露):
耐受性研究和藥代研究, PK/PD等;
確定健康人體耐受劑量、吸收、性別、食物影響等;
第二階段(健康人體):
藥物相互作用、QTc/血生化/免疫影響、PK/PD、群體藥代、體內(nèi)過程、代謝產(chǎn)物、酶底物等;
第三階段(患者體內(nèi)):
PK/PD、不同肝腎功能PK、患者藥代、患者的群體藥代等;
第一部分 倫理申請
1. 接到藥政管理當局(SDA)下達的批件;
2. 閱讀有關(guān)資料及文獻確定評價劑量;
3. 制定I期臨床試驗方案、CRF、IF;
4. 呈報倫理委員會審批;
5. 簽訂合同;
6. 接收試驗用藥;
7. 開始臨床研究。
第二部分 試驗準備工作
1. 招募志愿受試者;
2. 準備知情同意書;
3. 準備記錄表格與試驗流程圖;
4. 血藥濃度監(jiān)測方法標準化考核;
5. Ⅰ期病房準備(監(jiān)護、急救、觀察等);
6. 制定SOP,試驗 進度計劃;
第三部分 試驗進行
1. 受試者簽署知情同意書;
2. 篩選志愿受試者;
3. 合格受試者隨機分組;
4. 按照試驗方案與進度計劃進行Ⅰ期臨床試驗;
5. 及時填寫CRF。
第四部分 試驗結(jié)束
1. 數(shù)據(jù)處理、統(tǒng)計分析;
2. 總結(jié)報告。
1. 研究目的(主要、次要)
2. 研究設(shè)計
3. 志愿者選擇(入選、排除)
4. 劑量確定
5. 研究治療
6. 研究分配
7. 藥物供應(yīng)(劑型和包裝、準備和發(fā)放、藥物服用、依從性)
8. 藥物儲存和清點
9. 伴隨用藥
10. 試驗方法
11. 試驗藥物、試劑
12. 儀器設(shè)備
13. 研究程序(篩選、研究周期)
14. PK樣本的采集和分析(PK)
15. 志愿者退出
16. 評價(耐受性、PK、安全性、BE )
17. 不良事件報告(定義、報告期限、嚴重程度、SAE報告、因果關(guān)系)
18. 數(shù)據(jù)分析、統(tǒng)計學(xué)方法(樣本量、分析人群、PK、BE、安全性)
19. 質(zhì)量控制和保證
20. 數(shù)據(jù)處理分記錄保存(CRF/電子數(shù)據(jù)記錄、檔案)
21. 倫理(IRB/IEC)
22. 實驗研究的倫理指導(dǎo)
23. IF
24. 參考文獻
25. 縮寫
1. 單次耐受性試驗
(1)目的:獲得藥物人體安全性的最基本信息,為后期的試驗提供相對安全的劑量范圍。
(2)受試者:一般為健康志愿者,男女各半。可能有特殊或其他毒性作用的藥物,或?qū)γ庖呦到y(tǒng)等有較強影響的藥物,可以根據(jù)藥物的具體情況,選擇適宜的志愿者。
(3)劑量
①最低劑量:人的預(yù)期常規(guī)治療劑量的1/5-1/10;兩種敏感動物 LD 50的1/600 、毒性劑量的1/60和EDmin的1/60;據(jù) NOAELS計算最大推薦人體起始劑量等。
②最大劑量:可根據(jù)藥理學(xué)和毒理學(xué)的研究結(jié)果,參考同類藥物的臨床最大耐受劑量; 動物長毒試驗致中毒癥狀或臟器可逆性損害劑量的1/10,并應(yīng)超過臨床預(yù)期治療劑量。動物長毒試驗中最大耐受量的1/5~1/2等。
(4)分組:設(shè)若干劑量組(依藥效和毒性而定)。一般至少設(shè)5組,每組6-8人。各組應(yīng)另有若干名受試者接受安慰劑,特別是關(guān)鍵劑量組或可能產(chǎn)生毒性作用的劑量組。
(5)給藥
①由低向高劑量遞增進行。前一劑量組研究結(jié)束,且未顯示不能接受的AE時,方可進入下一劑量組試驗。
②每名受試者只能接受一個劑量的試驗,不得對同一受試者進行劑量遞增試驗或連續(xù)給藥,不得多個劑量組同時進行。
③如在遞增至設(shè)定的最大劑量時無臨床不能接受的任何不良反應(yīng)發(fā)生,則可結(jié)束耐受性試驗。
④如尚未達到設(shè)定的最大劑量時已出現(xiàn)不能接受的不良反應(yīng)時,則應(yīng)中止耐受性試驗。此時,前一組劑量即為耐受劑量。
(6)觀察指標:常規(guī)項目,依藥物特點而定
(7)觀察時間
①受試前1日,給藥后一定時間內(nèi)的時間點。
②當出現(xiàn)AE或Lab檢查等異常時,需追蹤至AE消失以及Lab檢查等恢復(fù)正常為止。
2. PK
(1)目的:闡明藥物在人體的吸收、分布、代謝和排泄規(guī)律,為制訂合理的臨床方案提供依據(jù)。
(2)受試者:8-12例,男女各半。選擇條件類似耐藥性研究。
(3)劑量確定:耐受性試驗中全組受試者均能耐受的若干個劑量。中間的劑量應(yīng)與臨床單次劑量相同或相近,幾個劑量間應(yīng)呈等比或等差關(guān)系。
(4)隨機方法:拉丁方等;
(5)采血點:據(jù)半衰期等確定。一般為:分布相或吸收相取3-4點,平衡相取2-3點,消除相4-6點,共計9-13點。
(6)樣本測定方法學(xué)要求:精確度、重復(fù)性、靈敏度、回收率、特異性、穩(wěn)定性等;
(7)數(shù)據(jù)處理與統(tǒng)計
3. 其他研究(略)
除了提供方法學(xué)報告、樣品分析報告、統(tǒng)計報告外,還需提供以下內(nèi)容:
①研究設(shè)計與研究方法
②測試方法及條件
③儀器與試劑
④方法學(xué)的標準化考核結(jié)果
⑤血濃度,尿濃度與尿累積排出百分率
⑥藥代動力學(xué)參數(shù)值。
⑦對所得藥代動力學(xué)參數(shù)進行分析,說明其臨床意義,對Ⅱ期臨床試驗方案提出建議。
1. 臨床試驗前(QA對SOP執(zhí)行情況進行確認并簽字)
(1)申辦方提供有關(guān)文件SOP;
(2)研究者和申辦方制定給藥方案CRF表的SOP;
(3)申請倫理委員會的SOP;
(4)試驗啟動前培訓(xùn)的SOP;
(5)接待監(jiān)查員的SOP;
(6)受試者招募的SOP;
(7)受試者知情同意的SOP;
(8)分析方法建立的SOP;
(9)試驗用品準備的SOP等。
2. 臨床試驗中(QA對SOP執(zhí)行情況進行確認并簽字)
①受試者入住I期病房的SOP;
②護士給藥的SOP;
③受試者監(jiān)護的SOP;
④樣品采集的SOP;
⑤樣品處理的SOP;
⑥ADR上報的SOP等。
3. 臨床試驗后(QA對SOP執(zhí)行情況進行確認并簽字)
①試驗總結(jié)報告書寫的SOP;
②試驗材料交付申辦方的SOP;
③試驗文件歸檔的SOP;
④樣品保存的SOP等。
現(xiàn)場核查由認證機構(gòu)進行審核,核查項目為SFDA。現(xiàn)場核查內(nèi)容主要包括軟件、硬件及具體項目情況三大部分組成。
(1)軟件包括:組織機構(gòu)、人員組成、資質(zhì)、SOP和制度、儀器管理和維修記錄、檔案;
(2)硬件包括:病房基本設(shè)施、搶救監(jiān)護設(shè)備、PK室條件;
(3)具體項目情況:文件、IF、CRF等等。

1. 房間:基本房屋是否有,設(shè)備如何;
2. 人員:資質(zhì)、GCP培訓(xùn)證書、問答等;
3. 儀器:基本設(shè)備是否有、使用、維護和維修記錄、冰箱/柜溫度測定儀器顯示和記錄、年檢證明等;
4. SOP和管理制度:(1)是否有、定期更新、更新計劃;(2)SOP和管理制度不僅裝訂成冊,還要把不同的SOP放在相應(yīng)的地方,隨時可以閱讀。
5. 檔案
| 批件(SFDA、EC) | 試驗藥/對照藥的檢驗合格報告 |
| 臨床試驗申請表 | IB、IB更新 |
| EC成員表 | 申辦方的企業(yè)資質(zhì)證明 |
| 方案、IF、CRF和原始病例表樣表/修訂案/最終版 | 完成的 IF、CRF和原始病例表(含淘汰部分) |
| GCP培訓(xùn)證書/記錄 | 參加人員的簡歷、資質(zhì)和證書、簽字樣張、PI授權(quán)表 |
| 試驗用藥品的標簽 | 藥品:接收、保存、分發(fā)、領(lǐng)取、銷毀、運單 |
| 篩選/入選、采血、體檢、隨機表 | PK實驗:實驗記錄、圖譜 |
| 實驗室證書、正常值范圍、實質(zhì)控證明 | 報告:總結(jié)、方法學(xué)、統(tǒng)計學(xué)、分析 |
| 監(jiān)察/稽查記錄 | 嚴重不良事件報告表(發(fā)生時) |
請一定要注意:“如果沒有書面記錄,那么就不是真實存在的” 。
如果您覺得自己不擅長辦理臨床試驗研究,覺得過程特別繁瑣。您不妨把公司的這項事宜委托給我們,思途是一家專業(yè)的臨床試驗代理機構(gòu),我們提供臨床Ⅰ、Ⅱ、Ⅲ、Ⅳ期服務(wù)。不僅如此,除了有藥物臨床服務(wù)外,我們還提供醫(yī)療器械多中心臨床服務(wù)。如您有所需求,不妨聯(lián)系我們。

站點聲明
本網(wǎng)站所提供的信息僅供參考之用,并不代表本網(wǎng)贊同其觀點,也不代表本網(wǎng)對其真實性負責(zé)。圖片版權(quán)歸原作者所有,如有侵權(quán)請聯(lián)系我們,我們立刻刪除。如有關(guān)于作品內(nèi)容、版權(quán)或其它問題請于作品發(fā)表后的30日內(nèi)與本站聯(lián)系,本網(wǎng)將迅速給您回應(yīng)并做相關(guān)處理。
鄭州思途醫(yī)療科技有限公司專注于醫(yī)療器械產(chǎn)品政策與法規(guī)規(guī)事務(wù)服務(wù),提供產(chǎn)品注冊備案申報代理、臨床試驗、體系建立輔導(dǎo)、分類界定、申請創(chuàng)新辦理服務(wù)。

盲法試驗常用的有兩種:單盲(single blinding)和雙盲(double blinding),更嚴格的對照試驗要用到三盲(triple blinding),在對照藥物和試驗藥物劑型或外觀不同時,還要用到雙盲雙模擬技

剛接觸CRO行業(yè)的小伙伴,在學(xué)習(xí)文件法規(guī)資料的同時,常看到一些英文類專業(yè)名詞不知道是什么意思。下面,一起看看常見的臨床試驗專業(yè)術(shù)語: CRO行業(yè)的常用術(shù)語解釋: 1:新藥研發(fā)
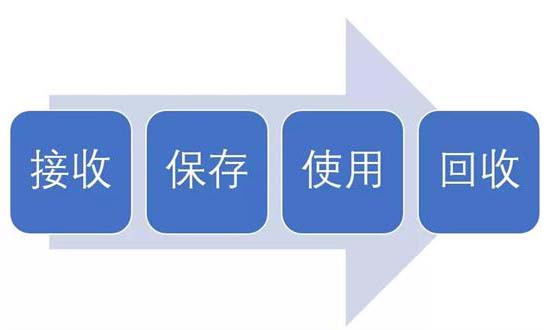
試驗用藥品是指用于臨床試驗的試驗藥物、對照藥品。試驗用藥品滲透到了臨床試驗過程中的每一個步驟,包括藥物的生產(chǎn)、包裝、運輸、保存、使用、回收等。今天我們從臨床試驗中

不少二三類需要臨床的產(chǎn)品,客戶一聽到臨床報價就退縮。既然這么貴,還不如自己做......事實真的是這樣嗎?臨床報價費用都由哪些組成?費用都誰收走了?自己做又有哪些風(fēng)險?文

大多數(shù)CRO公司在臨床試驗現(xiàn)場啟動會(SIV)上,常由CRA主導(dǎo)。作為一名有上進心的CRA必須清楚的了解到臨床試驗現(xiàn)場啟動考察的流程,再分享一些本人在啟動會考察的細節(jié),請看下文。

在臨床試驗中,無論是監(jiān)查員、質(zhì)控人員或者項目管理人員到研究中心查看項目資料的時候,總會多多少少發(fā)現(xiàn)一些問題,有些問題可能大家都比較熟知,但處理手法五花八門的。處理

我國GCP的附錄中也列出了類似必備文件,詳細內(nèi)容讀者可以參考這兩個規(guī)范的附錄部分。——《藥物臨床試驗與GCP實用指南》......下面介紹研究者應(yīng)當保存的重要文件及要求。"

關(guān)中心訪視(Close Out Visits,簡稱COV),想必大家都聽說過。作為臨床試驗最后一個階段,COV也是非常重要的一個環(huán)節(jié),今天和大家分享一下作為監(jiān)查員在COV時應(yīng)該做哪些工作。什么時候
隨機化被奉為臨床試驗設(shè)計的三大基本原則之一,隨機臨床試驗被視為臨床試驗的“金標準”,所產(chǎn)生的證據(jù)被循證醫(yī)學(xué)界確定為高等級證據(jù)。對于醫(yī)療器械臨床試驗,2018年1月由CFDA發(fā)

2019-12-01藥物臨床試驗機構(gòu)(簡稱機構(gòu))開始實行備案管理。本文結(jié)合機構(gòu)備案平臺構(gòu)建思路,著重介紹了備案平臺的結(jié)構(gòu)組成以及相關(guān)要求,梳理了機構(gòu)備案過程中的常見問題,對機構(gòu)
行業(yè)資訊
?
?
?
?
?
?
知識分享
法規(guī)文件
?
?
?
?
?
?
八年
醫(yī)療器械服務(wù)經(jīng)驗
聯(lián)系思途,免費獲得專屬《落地解決方案》及報價
咨詢相關(guān)問題或咨詢報價,可以直接與我們聯(lián)系
思途CRO——醫(yī)療器械注冊臨床第三方平臺
