體外診斷試劑ivd的貯存條件和運輸要求
在我國,體外診斷試劑(IVD)是指:可單獨使用或與儀器、器具、設備或系統(tǒng)組合使用, 在疾病的預防、診斷、治療監(jiān)測、預后觀察、健康狀態(tài)評價以及遺傳性疾病的預測過程中, 用于對人體樣


注冊備案 · 臨床試驗 · 體系建立輔導 · 分類界定 · 申請創(chuàng)新
來源:醫(yī)療器械注冊代辦 發(fā)布日期:2024-01-04 閱讀量:次

發(fā)布時間:2024-01-03
為加強醫(yī)療器械注冊申報和技術審評指導,國家藥監(jiān)局器審中心組織制修定了《體外診斷試劑主要原材料研究注冊審查指導原則》等12項注冊審查指導原則,現(xiàn)予發(fā)布。
特此通告。
附件:1.體外診斷試劑主要原材料研究注冊審查指導原則(下載)
2.布魯氏菌 IgM/IgG 抗體檢測試劑注冊審查指導原則(下載)
3.丙型肝炎病毒抗體檢測試劑注冊審查指導原則(下載)
4.寨卡病毒核酸檢測試劑注冊審查指導原則(下載)
5.曲霉核酸檢測試劑注冊審查指導原則(下載)
6.自測用血糖監(jiān)測系統(tǒng)注冊審查指導原則(2023年修訂版)(下載)
7.體外診斷試劑說明書編寫指導原則(2023年修訂版)(下載)
8.腫瘤標志物類定量檢測試劑注冊審查指導原則(2023年修訂版)(下載)
9.流行性感冒病毒核酸檢測試劑注冊審查指導原則(2023年修訂版)(下載)
10.流行性感冒病毒抗原檢測試劑注冊審查指導原則(2023年修訂版)(下載)
11.病原體特異性M型免疫球蛋白定性檢測試劑注冊審查指導原則(2023年修訂版)(下載)
12.乙型肝炎病毒脫氧核糖核酸檢測試劑注冊審查指導原則(2023年修訂版)(下載)
國家藥品監(jiān)督管理局
醫(yī)療器械技術審評中心
2024年1月2日

站點聲明
本網(wǎng)站所提供的信息僅供參考之用,并不代表本網(wǎng)贊同其觀點,也不代表本網(wǎng)對其真實性負責。圖片版權歸原作者所有,如有侵權請聯(lián)系我們,我們立刻刪除。如有關于作品內容、版權或其它問題請于作品發(fā)表后的30日內與本站聯(lián)系,本網(wǎng)將迅速給您回應并做相關處理。
鄭州思途醫(yī)療科技有限公司專注于醫(yī)療器械產(chǎn)品政策與法規(guī)規(guī)事務服務,提供產(chǎn)品注冊備案申報代理、臨床試驗、體系建立輔導、分類界定、申請創(chuàng)新辦理服務。

在我國,體外診斷試劑(IVD)是指:可單獨使用或與儀器、器具、設備或系統(tǒng)組合使用, 在疾病的預防、診斷、治療監(jiān)測、預后觀察、健康狀態(tài)評價以及遺傳性疾病的預測過程中, 用于對人體樣

為規(guī)范醫(yī)療器械(含體外診斷試劑)注冊管理,根據(jù)國家藥監(jiān)局《關于公布醫(yī)療器械注冊申報資料要求和批準證明文件格式的公告》(2021年第121號)、《關于公布體外診斷試劑注冊申報

體外診斷試劑臨床試驗數(shù)據(jù)造假行為,怎么處罰?本文針對體外診斷試劑注冊環(huán)節(jié)的臨床試驗數(shù)據(jù)造假行為,一起來看看懲罰力度。

近日美國食品藥品監(jiān)督管理局(FDA)更新了《醫(yī)療器械提交的反饋申請和會議申請:Q-Submission指導原則》。此文件是對2019版Q-sub指導原則的更新,更新的主要內容如下:1. 增加了STeP醫(yī)療

為進一步規(guī)范體外診斷試劑的管理,國家藥監(jiān)局器審中心組織制定了《人類SDC2基因甲基化檢測試劑臨床試驗資料技術審評要點》、《異常凝血酶原測定試劑臨床試驗資料技術審評要點》

2016年起,醫(yī)療機構對有冷鏈要求的體外診斷試劑實施了入庫驗收制度,要求供應商按照醫(yī)院規(guī)定的時間將產(chǎn)品送到科室,必須由試劑管理部門驗收人員、科室人員雙方一起驗收,驗收要

國家藥監(jiān)局器審中心關于發(fā)布定性檢測體外診斷試劑分析性能評估等6項醫(yī)療器械產(chǎn)品注冊審查指導原則的通告(2022年第36號) 發(fā)布時間:2022-09-28 為進一步規(guī)范定性檢測體外診斷試劑分析
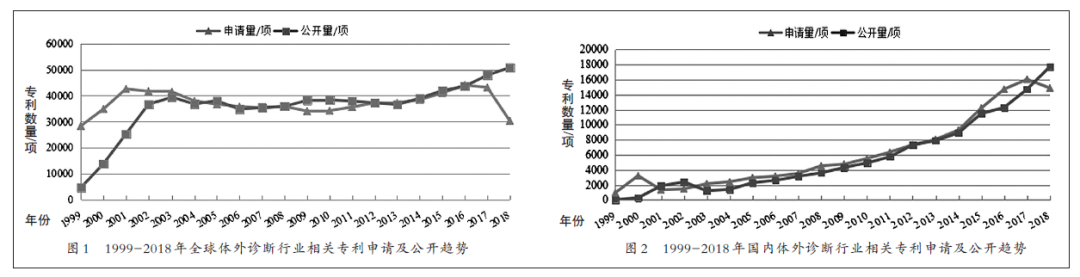
體外診斷(In Vitro Diagnosis,下稱IVD),是在人體之外,通過對人體樣本(血液、體液、組織等)進行檢測而獲取臨床診斷信息,進而判斷疾病或機體功能的產(chǎn)品和服務。IVD已經(jīng)成為人類
為貫徹落實省委省政府關于鼓勵支持醫(yī)療器械研究與創(chuàng)新的決策部署,加快創(chuàng)新醫(yī)療器械上市審批,促進新技術的推廣和應用,推動醫(yī)療器械產(chǎn)業(yè)高質量發(fā)展,江蘇省藥品監(jiān)督管理局決
思途給大家提供免于醫(yī)療器械注冊質量管理體系核查相關說明的全文內容和文檔下載,如果您有免于醫(yī)療器械注冊質量管理體系核查相關說明的相關臨床需求請及時找思途,關注思途了
行業(yè)資訊
?
?
?
?
?
?
知識分享
八年
醫(yī)療器械服務經(jīng)驗
聯(lián)系思途,免費獲得專屬《落地解決方案》及報價
咨詢相關問題或咨詢報價,可以直接與我們聯(lián)系
思途CRO——醫(yī)療器械注冊臨床第三方平臺
