醫(yī)療器械泰國(guó)Thai FDA注冊(cè)及其審批途徑
來(lái)源:醫(yī)療器械注冊(cè)代辦 發(fā)布日期:2024-02-22 閱讀量:次
泰國(guó)是東南亞主要的醫(yī)療器械市場(chǎng)之一。在泰國(guó),醫(yī)療器械受公共衛(wèi)生部下屬的泰國(guó)食品和藥物管理局(Thai FDA)監(jiān)管,以確保醫(yī)療器械的安全性、有效性和合規(guī)性。在醫(yī)療器械產(chǎn)品合法引入泰國(guó)市場(chǎng)之前,需要在Thai FDA進(jìn)行注冊(cè)。
當(dāng)?shù)氐闹饕ㄒ?guī)為Medical Device Act B.E. 2551 (2008)和Medical Device Act (2nd Edition) B.E. 2562 (2019) 等。另外作為東盟ASEAN成員國(guó),泰國(guó)也會(huì)參考東盟相關(guān)法規(guī)。
境外制造商首先需要在泰國(guó)指定授權(quán)當(dāng)?shù)卮砣恕W?cè)證有效期為5年,會(huì)頒發(fā)給該當(dāng)?shù)卮怼D壳疤﹪?guó)法規(guī)規(guī)定不可變更代理人,但同一產(chǎn)品可以同時(shí)有多個(gè)當(dāng)?shù)卮砣恕?/strong>
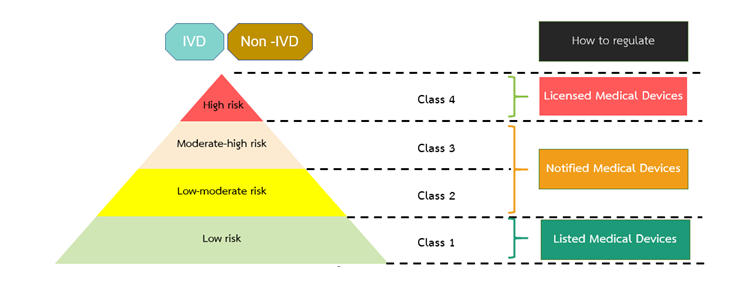
醫(yī)療器械(包括IVD)產(chǎn)品的風(fēng)險(xiǎn)分類主要取決于器械的性質(zhì)和預(yù)期用途。在泰國(guó),醫(yī)療器械風(fēng)險(xiǎn)等級(jí)由低風(fēng)險(xiǎn)向高風(fēng)險(xiǎn)依次分為Class 1, Class 2, Class 3和Class 4四類。
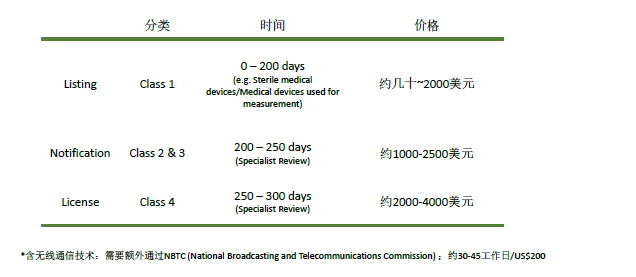
根據(jù)風(fēng)險(xiǎn)等級(jí)不同,Thai FDA的監(jiān)管力度也會(huì)不同。最低風(fēng)險(xiǎn)的1類產(chǎn)品只需要列名(listing),風(fēng)險(xiǎn)較高的2類和3類產(chǎn)品需要進(jìn)行通知(Notification),而風(fēng)險(xiǎn)最高的4類產(chǎn)品則需要批準(zhǔn)許可(License)。
在泰國(guó)主要有三種注冊(cè)路徑:
“簡(jiǎn)潔路徑”(Concise pathway)適用于在參考國(guó)家(歐盟、加拿大、日本、澳大利亞、美國(guó)或WHO Prequalification)注冊(cè)過(guò)的產(chǎn)品,該產(chǎn)品需要在至少一個(gè)參考國(guó)家成功注冊(cè)并上市1年以上,且無(wú)嚴(yán)重不良事件。
類似的“信賴計(jì)劃”(Reliance program)則適用于已在新加坡HSA成功注冊(cè)的醫(yī)療器械產(chǎn)品。
如產(chǎn)品不滿足以上兩個(gè)情況的話,則需要走全流程審批路徑(Full evaluation)
所有風(fēng)險(xiǎn)等級(jí)的產(chǎn)品技術(shù)文件均需參考東盟通用提交檔案模板CSDT(Common Submission Dossier Template) 。另外對(duì)于2、3、4類產(chǎn)品,需要ISO 13485質(zhì)量管理體系。
根據(jù)不同產(chǎn)品風(fēng)險(xiǎn)等級(jí)以及產(chǎn)品的具體情況,泰國(guó)注冊(cè)的時(shí)間可能需要0-300天。費(fèi)用也會(huì)從幾十美元到4000美元不等。
思途CRO海外團(tuán)隊(duì)可協(xié)助您完成泰國(guó)Thai FDA產(chǎn)品注冊(cè),為您提供泰國(guó)當(dāng)?shù)卮矸?wù)。如果想具體了解您產(chǎn)品在泰國(guó)的注冊(cè)情況,歡迎聯(lián)系我們18603823910。
本網(wǎng)站所提供的信息僅供參考之用,并不代表本網(wǎng)贊同其觀點(diǎn),也不代表本網(wǎng)對(duì)其真實(shí)性負(fù)責(zé)。圖片版權(quán)歸原作者所有,如有侵權(quán)請(qǐng)聯(lián)系我們,我們立刻刪除。如有關(guān)于作品內(nèi)容、版權(quán)或其它問(wèn)題請(qǐng)于作品發(fā)表后的30日內(nèi)與本站聯(lián)系,本網(wǎng)將迅速給您回應(yīng)并做相關(guān)處理。
鄭州思途醫(yī)療科技有限公司專注于醫(yī)療器械產(chǎn)品政策與法規(guī)規(guī)事務(wù)服務(wù),提供產(chǎn)品注冊(cè)備案申報(bào)代理、臨床試驗(yàn)、體系建立輔導(dǎo)、分類界定、申請(qǐng)創(chuàng)新辦理服務(wù)。



















 豫公網(wǎng)安備 41010202003160號(hào)
豫公網(wǎng)安備 41010202003160號(hào)