臨床試驗中的單盲、雙盲、三盲、破盲是什么意思?
盲法試驗常用的有兩種:單盲(single blinding)和雙盲(double blinding),更嚴格的對照試驗要用到三盲(triple blinding),在對照藥物和試驗藥物劑型或外觀不同時,還要用到雙盲雙模擬技


注冊備案 · 臨床試驗 · 體系建立輔導 · 分類界定 · 申請創(chuàng)新
來源:醫(yī)療器械注冊代辦 發(fā)布日期:2023-08-22 閱讀量:次
現(xiàn)在國內已經(jīng)有倫理委員會要求susar遞交前需要進行破盲。由于在國內現(xiàn)行的管理規(guī)范及指導原則中[1, 2],未明文規(guī)定遞交給倫理委員會的信息是否需要揭盲,目前并無官方的統(tǒng)一標準。

對于這一要求,我的思考是:可以向倫理委員會遞交破盲的SUSAR報告,而倫理也應當協(xié)助申辦者完成試驗的盲態(tài)維持工作。但基于當前臨床試驗環(huán)境,需要仔細斟酌在這一改革中投入的資源能收獲多少回報。
對于倫理委員會而言,獲得揭盲的SUSAR報告可以更好地監(jiān)測試驗的SUSAR信息,有助于保護受試者的權益、安全;可以將對照藥物的SUSAR進行排除,避免誤判,從而更準確地評估試驗藥物安全性。
但對于申辦者而言,新增倫理作為破盲信息接收人,一方面會在研究中心增加獲知非盲信息的人員,給試驗的盲態(tài)維持帶來挑戰(zhàn);另一方面,新建立的破盲遞交環(huán)節(jié)需要進行質量控制及質量保證;此外,這也是對大多數(shù)臨床試驗藥物警戒計劃、盲態(tài)維持計劃的偏離(在當前的實踐中,倫理委員會屬于盲態(tài)角色,不能接受非盲信息)。
申辦者會需要對特定臨床試驗,乃至公司層級的管理文件進行更新。因此向倫理委員會發(fā)送揭盲SUSAR報告目前在國內僅處于起步階段,尚沒有成熟的流程及經(jīng)驗可以參考。
向倫理委員會報告SUSAR并不違反相關規(guī)定,也有相應的理論進行支撐,只是這:
1.各國監(jiān)管機構(FDA、EMA、CDE等)都要求SUSAR提交前進行揭盲。監(jiān)管機構要求審閱破盲SUSAR報告的理由及原因,同樣適用于各倫理委員會。
盲態(tài)遞交環(huán)節(jié)中的陽性對照藥組或安慰劑組SUSAR報告,稀釋了倫理的審評資源,不利于提高倫理監(jiān)管工作的質量和效率,另外也可能讓倫理委員會對試驗藥物的安全性判斷產(chǎn)生偏移。
以下引用國家藥品監(jiān)督管理局藥品審評中心老師在2020年發(fā)表的一篇文章《我國藥物臨床試驗期間可疑且非預期嚴重不良反應快速報告存在的問題及報告要求》[3]。需要注意這是2020年時的數(shù)據(jù),在2022年新發(fā)布的《常見問題及建議》中已經(jīng)不存在以下兩個問題[4]:
2.4 誤將陽性對照藥或安慰劑組的個例報告遞交藥審中心
2.4.1存在問題
將臨床試驗中陽性對照藥組或安慰劑組的個例快速報告遞交藥審中心,導致藥審中心開展安全性評估監(jiān)測工作效率降低。
2.4.2分析思考
SUSAR快速報告的目的是對于臨床試驗期間的藥物安全性進行動態(tài)評估及風險控制。因此,應將試驗藥物的SUSAR報告藥審中心,以便于藥審中心開展IND申報審批藥物的臨床試驗期間的風險監(jiān)管。
而陽性對照藥為已上市藥品,我國對于已上市藥品不良反應的監(jiān)測職責隸屬于藥品評價中心(國家藥品不良反應監(jiān)測中心),因此,作為陽性對照藥的已上市藥品的嚴重不良反應,可向藥品評價中心(國家藥品不良反應監(jiān)測中心)報告;也可根據(jù)E2A相關規(guī)定,告知已上市藥品的生產(chǎn)商。安慰劑組的個例事件,不需進行快速報告。總之,陽性對照藥或安慰劑組的個例不需向藥審中心進行快速報告。
2.5 未進行個例破盲而按照SUSAR進行報告
2.5.1 存在問題
按照SUSAR進行報告,但未實施個例破盲,尚不明確組別。
2.5.2 分析思考
在藥物臨床試驗期間,申請人和/或研究者判斷與試驗藥物肯定相關或可疑的非預期嚴重不良反應,申請人應按照SUSAR進行快速報告。因此,SUSAR報告的前提條件之一是病例使用了試驗藥物。
根據(jù)E2A,如果事件是嚴重、新發(fā)的且可能與藥物有關的話,“在保持盲態(tài)的狀況下通知有關機構是不恰當?shù)牟⒖赡苷`導”;因此,對于嚴重不良事件/不良反應,應盡可能進行全面、深入分析,在必要時進行個例破盲,以進一步評估風險,但整體試驗仍保持盲態(tài),對研究結果進行分析和闡述的人員仍保持盲態(tài)。
2.遞交破盲報告至倫理委員會廣泛適用于歐洲藥品管理局的管理范圍,申辦者可參考國外的經(jīng)驗建立相應遞交環(huán)節(jié)。雖然中國與FDA沒有要求,但歐洲藥品管理局要求向適用成員國的倫理委員會提交破盲SUSAR報告(Document 52011XC0611(01),章節(jié)7.11.1,條目111和114)[5, 6]。
目前約有22個國家的倫理委員會要求提交非盲的安全性報告[7],例如比利時就是此類國家之一[8]。
3.對于需要重點關注安全性事件的臨床試驗中,往往已建立獨立的數(shù)據(jù)監(jiān)查委員會(DMC)與數(shù)據(jù)安全監(jiān)查委員會(DSMB),定期對臨床試驗的進展、安全性數(shù)據(jù)和重要的有效性終點進行評估,并向申辦者建議是否繼續(xù)、調整或者停止試驗。
這類部門作為申辦者設立的獨立的具有相關專業(yè)知識和經(jīng)驗的專家組,可獲得的相關參考資料更為廣泛細致,對于試驗藥物的參考安全信息(Reference Safety Information)理解更為深入。倫理委員會需要很多時間與精力才能較好地對安全性事件完成審查。
但倫理委員會同時負責多個臨床試驗的審查工作,職責眾多,且工作強度普遍很高,在安全性事件的管理上投入的精力不一定能獲得足夠回報,將相關資源投入在研究者教育、知情同意的培訓上可能收獲更大。
4.為實現(xiàn)臨床試驗的盲態(tài)保持,倫理委員會僅能在最小范圍內授權人員獲得破盲信息,且獲得破盲信息的人員應當回避相應的臨床試驗工作。
當倫理委員會在破盲SUSAR報告審查后需要研究中心/試驗采取相應措施時,如何在保持盲態(tài)的情況下有效傳達審查意見及要求是個充滿挑戰(zhàn)的過程。
此外,破盲SUSAR遞交環(huán)節(jié)的建立也并不容易,需要考慮多個方面:
(1)破盲文件的遞交流程是否有明確規(guī)定及書面的操作流程指導
(2)遞交的流程及系統(tǒng)是否有足夠的保障,如:遞交環(huán)節(jié)是否清晰簡潔(避免盲態(tài)成員參與,減少中間環(huán)節(jié))、倫理的SUSAR管理系統(tǒng)是否有相應的資格認定及核驗證書(受控的訪問權限、登錄超時、數(shù)據(jù)完整性、稽查軌跡等進行考察)
(3)遞交破盲信息后,該破盲信息在中心是否受控(可查看到揭盲信息的人員是否具有相應資質、該人員是否與試驗無關、破盲信息是否會被擴散)
以上就是關于是否可以給倫理發(fā)送破盲SUSAR報告的相關思考了。謝謝大家的閱讀。
1.《藥物臨床試驗質量管理規(guī)范》.
https://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20200426162401243.html.
2.《藥物警戒質量管理規(guī)范》.
https://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20210513151827179.html.
3.李艷蓉、裴小靜、胡洋平、陳方、楊策、王海學, 我國藥物臨床試驗期間可疑且非預期嚴重不良反應快速報告存在的問題及報告要求. 中國臨床藥理學雜志, 2020. 36(21): p. 5.
4.劉敏, 裴小靜, and 王海學, 我國藥物臨床試驗期間可疑且非預期嚴重不良反應快速報告的常見問題及建議. 中國藥物警戒, 2022. 19(2): p. 176.
5.Communication from the Commission — Detailed guidance on the collection, verification and presentation of adverse event/reaction reports arising from clinical trials on medicinal products for human use ( CT-3 ).
https://eur-lex.europa.eu/legal-content/EN/TXT/?uri=CELEX:52011XC0611(01).
6.Breaking the Blind in Clinical Trials & Reporting to Health Authorities, Investigators & IRBs/Ethics Committees.
https://lifesciencescare.hcltech.com/blog/breaking-the-blind-in-clinical-trials-reporting-to-health-authorities-investigators-irbsethics-committees/.
7. Global SUSAR Distribution: Lack Of Regulatory Harmony Puts Trials At Risk.
https://www.clinicalleader.com/doc/global-susar-distribution-lack-of-regulatory-harmony-puts-trials-at-risk-0001.
8. New circular 586 on the reporting of adverse events observed in clinical trials and submission of annual safety reports. https://www.famhp.be/en/news/news_circulaire_586.
來源:煎茶員日記

站點聲明
本網(wǎng)站所提供的信息僅供參考之用,并不代表本網(wǎng)贊同其觀點,也不代表本網(wǎng)對其真實性負責。圖片版權歸原作者所有,如有侵權請聯(lián)系我們,我們立刻刪除。如有關于作品內容、版權或其它問題請于作品發(fā)表后的30日內與本站聯(lián)系,本網(wǎng)將迅速給您回應并做相關處理。
鄭州思途醫(yī)療科技有限公司專注于醫(yī)療器械產(chǎn)品政策與法規(guī)規(guī)事務服務,提供產(chǎn)品注冊備案申報代理、臨床試驗、體系建立輔導、分類界定、申請創(chuàng)新辦理服務。

盲法試驗常用的有兩種:單盲(single blinding)和雙盲(double blinding),更嚴格的對照試驗要用到三盲(triple blinding),在對照藥物和試驗藥物劑型或外觀不同時,還要用到雙盲雙模擬技

病例報告表(CRF)是臨床試驗中記錄臨床資料的表格,每一受試者有關試驗的資料均應記錄在預先按試驗方案設計的病例報告表中。它們依據(jù)原始記錄而填寫,以便申辦者對不同試驗單
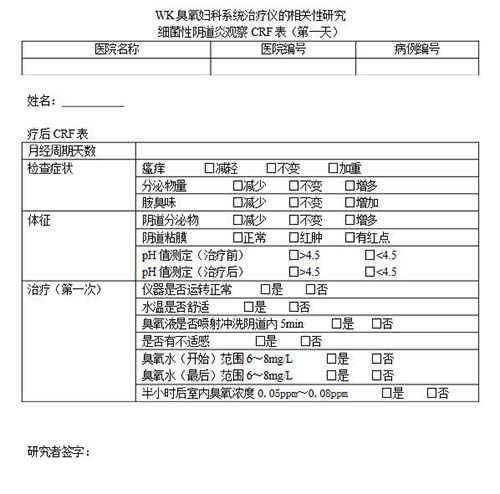
病例報告表(case report form,CRF)是按照臨床試驗方案的要求設計的書面文件,用于記錄和報告每一名受試者在試驗過程中的數(shù)據(jù),這種文件一般采用表格(紙質或電子)的形式。"

之前關于倫理委員會的文章中,我們提到了區(qū)域倫理委員會、倫理委員會常見問題、倫理委員會的職責和要求、倫理委員會標準操作規(guī)程及常用表格,唯獨缺了倫理委員會的人員組成和

病例報告表 (CRF填寫指南) (第1版) 一、制定本指南目的: 為加強對醫(yī)療器械臨床研究的監(jiān)督管理,保證臨床病歷報告表記錄真實、規(guī)范、完整,提高臨床試驗的質量,根據(jù)《醫(yī)療

倫理委員會(Ethics Committee)是由醫(yī)學專業(yè)人員、法律專家及非醫(yī)務人員組成的獨立組織,其職責為核查臨床試驗方案及附件是否合乎道德,并為之提供公眾保證,確保受試者的安全、健

醫(yī)療器械注冊檢驗報告的有效期,行業(yè)內常聽到各種說法,一起來看一下效期是怎么規(guī)定的。"
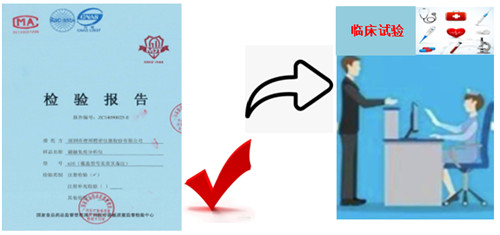
眾所周知,開展藥物臨床試驗必須提供臨床試驗用藥物的藥檢報告;同樣,申請醫(yī)療器械臨床試驗產(chǎn)品檢驗報告也是不可或缺的。只有檢驗合格,方可開展臨床試驗或者申請注冊、進行

如題所示,如何寫好監(jiān)查報告?先看一下ICH-GCP1.38對于監(jiān)查的定義:監(jiān)督一個臨床試驗的發(fā)展,保證臨床試驗按照臨床方案、標準操作規(guī)程(SOP)、臨床試驗質量管理規(guī)范(GCP)和相應的
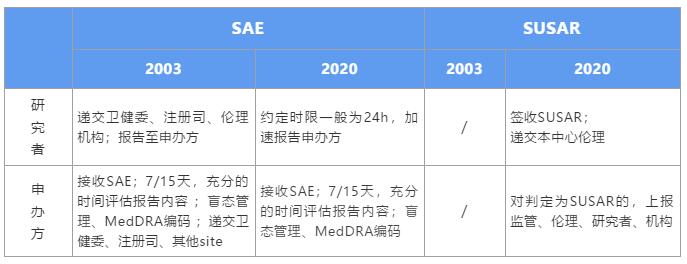
新版GCP對于申辦方的影響是全方位的,就SAE個例報告處理方面,強化了申辦方的主體責任,細化了申辦方對SAE的管理流程。在此,我們詳細解讀,在新規(guī)之下,該如何高效、合規(guī)的處理
行業(yè)資訊
?
?
?
?
?
?
知識分享
八年
醫(yī)療器械服務經(jīng)驗
聯(lián)系思途,免費獲得專屬《落地解決方案》及報價
咨詢相關問題或咨詢報價,可以直接與我們聯(lián)系
思途CRO——醫(yī)療器械注冊臨床第三方平臺
