淺談病例報(bào)告表設(shè)計(jì)/填寫與更正(附病例報(bào)告表模板)
病例報(bào)告表(CRF)是臨床試驗(yàn)中記錄臨床資料的表格,每一受試者有關(guān)試驗(yàn)的資料均應(yīng)記錄在預(yù)先按試驗(yàn)方案設(shè)計(jì)的病例報(bào)告表中。它們依據(jù)原始記錄而填寫,以便申辦者對(duì)不同試驗(yàn)單


注冊(cè)備案 · 臨床試驗(yàn) · 體系建立輔導(dǎo) · 分類界定 · 申請(qǐng)創(chuàng)新
來(lái)源:醫(yī)療器械注冊(cè)代辦 發(fā)布日期:2024-09-13 閱讀量:次
在臨床試驗(yàn)中,嚴(yán)重不良事件(SAE)的及時(shí)報(bào)告對(duì)于保障受試者的安全至關(guān)重要。根據(jù)《藥物臨床試驗(yàn)質(zhì)量管理規(guī)范》(GCP)的要求,嚴(yán)重不良事件的報(bào)告流程需要嚴(yán)格遵循,以確保所有相關(guān)方能夠及時(shí)采取必要的行動(dòng)。本文將詳細(xì)介紹如何按照規(guī)定報(bào)告嚴(yán)重不良事件。

根據(jù)《藥物臨床試驗(yàn)質(zhì)量管理規(guī)范》要求申辦者應(yīng)將試驗(yàn)用藥物非預(yù)期的嚴(yán)重不良事件向藥品監(jiān)督管理部門和衛(wèi)生行政部門報(bào)告,死亡和危及生命情況為7天,其他情況為15天。隨后,申辦者應(yīng)按照制藥SOP規(guī)定的程序向研究者搜集該SAE的詳細(xì)資料。研究者應(yīng)確保向申辦者全面、詳細(xì)地提供SAE的有關(guān)情況。同時(shí),研究者有義務(wù)按中國(guó)法律、法規(guī)的規(guī)定向有關(guān)各方報(bào)告SAE。此外,如發(fā)生嚴(yán)重的與試驗(yàn)用藥物相關(guān)的、且以前未知的(未在研究者手冊(cè)中記載的)不良反應(yīng),研究者應(yīng)及時(shí)向倫理委員會(huì)報(bào)告。
嚴(yán)重不良事件的報(bào)告是臨床試驗(yàn)中一項(xiàng)極其重要的工作,其目的在于保護(hù)受試者的安全,確保臨床試驗(yàn)的科學(xué)性和可靠性。申辦者和研究者在這一過(guò)程中各自承擔(dān)不同的職責(zé),包括及時(shí)向相關(guān)監(jiān)管機(jī)構(gòu)報(bào)告、搜集詳細(xì)資料并向倫理委員會(huì)匯報(bào)。通過(guò)嚴(yán)格遵循GCP的要求,確保所有嚴(yán)重不良事件得到妥善處理,不僅能夠保障受試者的權(quán)益,也為新藥的研發(fā)提供了重要的安全信息。希望本文能夠幫助相關(guān)從業(yè)人員更好地理解嚴(yán)重不良事件報(bào)告的重要性和具體操作流程。

站點(diǎn)聲明
本網(wǎng)站所提供的信息僅供參考之用,并不代表本網(wǎng)贊同其觀點(diǎn),也不代表本網(wǎng)對(duì)其真實(shí)性負(fù)責(zé)。圖片版權(quán)歸原作者所有,如有侵權(quán)請(qǐng)聯(lián)系我們,我們立刻刪除。如有關(guān)于作品內(nèi)容、版權(quán)或其它問(wèn)題請(qǐng)于作品發(fā)表后的30日內(nèi)與本站聯(lián)系,本網(wǎng)將迅速給您回應(yīng)并做相關(guān)處理。
鄭州思途醫(yī)療科技有限公司專注于醫(yī)療器械產(chǎn)品政策與法規(guī)規(guī)事務(wù)服務(wù),提供產(chǎn)品注冊(cè)備案申報(bào)代理、臨床試驗(yàn)、體系建立輔導(dǎo)、分類界定、申請(qǐng)創(chuàng)新辦理服務(wù)。

病例報(bào)告表(CRF)是臨床試驗(yàn)中記錄臨床資料的表格,每一受試者有關(guān)試驗(yàn)的資料均應(yīng)記錄在預(yù)先按試驗(yàn)方案設(shè)計(jì)的病例報(bào)告表中。它們依據(jù)原始記錄而填寫,以便申辦者對(duì)不同試驗(yàn)單

脫落是每個(gè)臨床試驗(yàn)中都會(huì)出現(xiàn)并且也最讓人頭痛的現(xiàn)象。但是是什么原因引起脫落而我們?cè)趺床拍軠p少脫落呢?那么我們來(lái)談一下,項(xiàng)目中常見(jiàn)的脫落問(wèn)題,希望能為各位項(xiàng)目人員提
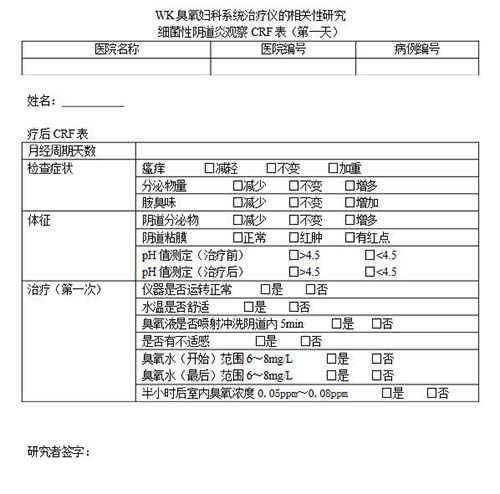
病例報(bào)告表(case report form,CRF)是按照臨床試驗(yàn)方案的要求設(shè)計(jì)的書面文件,用于記錄和報(bào)告每一名受試者在試驗(yàn)過(guò)程中的數(shù)據(jù),這種文件一般采用表格(紙質(zhì)或電子)的形式。"

隨著越來(lái)越多的臨床試驗(yàn)中都配備 CRA,CRA 與 CRC 在臨床試驗(yàn)中的作用及合作值得大家一起探討。首先,介紹一下在項(xiàng)目運(yùn)行中可能出現(xiàn)的問(wèn)題和矛盾,間接影響了項(xiàng)目的執(zhí)行和質(zhì)量。希

作為一名苦逼的CRA,除了日常的監(jiān)查工作以外,也許還有一個(gè)讓人很頭疼的問(wèn)題,每次項(xiàng)目會(huì)議上PM重復(fù)又重復(fù)了的話題:“親,這個(gè)Site的進(jìn)度太慢啦,想想辦法啊!CRA:我在想 我在想

臨床CCG是什么意思?CCG是數(shù)據(jù)填寫指南,由DM起草,相關(guān)人員審核,可能包括PM,醫(yī)學(xué),藥物警戒等,主要是給數(shù)據(jù)庫(kù)錄入人員CRC.PI.以及發(fā)布質(zhì)疑的CRA和醫(yī)學(xué)使用的指南文件。

在臨床試驗(yàn)方案的設(shè)計(jì)過(guò)程中,大家都會(huì)盡可能的考慮到各種可能影響試驗(yàn)的因素,并制定標(biāo)準(zhǔn)操作規(guī)程,盡量避免和減少在試驗(yàn)中可能出現(xiàn)違背及偏離方案的情況發(fā)生,但在試驗(yàn)的執(zhí)

病例報(bào)告表 (CRF填寫指南) (第1版) 一、制定本指南目的: 為加強(qiáng)對(duì)醫(yī)療器械臨床研究的監(jiān)督管理,保證臨床病歷報(bào)告表記錄真實(shí)、規(guī)范、完整,提高臨床試驗(yàn)的質(zhì)量,根據(jù)《醫(yī)療

在CRO中,被公司內(nèi)部指派任務(wù)還不夠,有些申辦方除了需要看簡(jiǎn)歷之外還有面試一環(huán),只有通過(guò)面試并得到認(rèn)可才能上崗接他們家的項(xiàng)目。這是無(wú)論CRA或PM都會(huì)有的待遇,所以不要悲傷和

醫(yī)療器械注冊(cè)檢驗(yàn)報(bào)告的有效期,行業(yè)內(nèi)常聽到各種說(shuō)法,一起來(lái)看一下效期是怎么規(guī)定的。"
行業(yè)資訊
?
?
?
?
?
?
知識(shí)分享
?
?
?
?
?
?
法規(guī)文件
?
?
?
?
?
?
八年
醫(yī)療器械服務(wù)經(jīng)驗(yàn)
聯(lián)系思途,免費(fèi)獲得專屬《落地解決方案》及報(bào)價(jià)
咨詢相關(guān)問(wèn)題或咨詢報(bào)價(jià),可以直接與我們聯(lián)系
思途CRO——醫(yī)療器械注冊(cè)臨床第三方平臺(tái)
