CDE各申請類型審批周期/各適應(yīng)癥的負(fù)責(zé)人及聯(lián)系方式
審評時間 工作程序 審評工作程序 行政審批備案工作程序 項(xiàng)目管理人員公示信息 一、化藥及生物制品 二、中藥 審評業(yè)務(wù)聯(lián)系郵箱 在審化藥新藥注冊申請相關(guān)問題:huayaoxinyao@cde.org.c


注冊備案 · 臨床試驗(yàn) · 體系建立輔導(dǎo) · 分類界定 · 申請創(chuàng)新
來源:醫(yī)療器械注冊代辦 發(fā)布日期:2025-01-23 閱讀量:次

依據(jù)國家藥品監(jiān)督管理局《創(chuàng)新醫(yī)療器械特別審查程序》(國家藥監(jiān)局2018年第83號公告),創(chuàng)新醫(yī)療器械審查辦公室組織有關(guān)專家對創(chuàng)新醫(yī)療器械特別審查申請進(jìn)行審查,擬同意以下申請項(xiàng)目進(jìn)入特別審查程序,現(xiàn)予以公示。公示時間為2025年1月21日至2月10日。
1.產(chǎn)品名稱:脫細(xì)胞結(jié)膜基質(zhì)
申 請 人:拜歐迪賽爾(成都)生物科技有限公司
2.產(chǎn)品名稱:外科生物補(bǔ)片
申 請 人:卓阮醫(yī)療科技(蘇州)有限公司
3.產(chǎn)品名稱:青光眼引流器
申 請 人:蘇州朗目醫(yī)療科技有限公司
4.產(chǎn)品名稱:金屬增材制造椎間融合器
申 請 人:北京愛康宜誠醫(yī)療器材有限公司
5.產(chǎn)品名稱:自膨式可載粒子門靜脈支架
申 請 人:南京融晟醫(yī)療科技有限公司
6.產(chǎn)品名稱:連續(xù)無針給藥系統(tǒng)
申 請 人:江蘇樂聚醫(yī)藥科技有限公司
7.產(chǎn)品名稱:顱內(nèi)取栓支架
申 請 人:紐瓦斯克醫(yī)療科技有限公司
8.產(chǎn)品名稱:分支型術(shù)中支架系統(tǒng)
申 請 人:江蘇百優(yōu)達(dá)生命科技有限公司
9.產(chǎn)品名稱:可降解卵圓孔未閉封堵器
申 請 人:無憂跳動醫(yī)療科技(深圳)有限公司
公示期內(nèi),任何單位和個人如有異議,可書面提交異議意見,發(fā)送至我中心電子郵箱:gcdivision@cmde.org.cn。
特別說明:進(jìn)入創(chuàng)新審查程序不代表已認(rèn)定產(chǎn)品具備可獲準(zhǔn)注冊的安全有效性,申請人仍需按照有關(guān)要求開展研發(fā)及提出注冊申請,藥品監(jiān)督管理部門及相關(guān)技術(shù)機(jī)構(gòu)將按照早期介入、專人負(fù)責(zé)、科學(xué)審查的原則,在標(biāo)準(zhǔn)不降低、程序不減少的前提下進(jìn)行審評審批。
國家藥品監(jiān)督管理局
醫(yī)療器械技術(shù)審評中心
2025年1月21日

依據(jù)原國家食品藥品監(jiān)督管理總局《醫(yī)療器械優(yōu)先審批程序》(總局公告2016年168號),對申請優(yōu)先審批的醫(yī)療器械注冊申請進(jìn)行審核,現(xiàn)將符合優(yōu)先審批情形的項(xiàng)目予以公示,公示時間為2024年1月21日至1月27日。
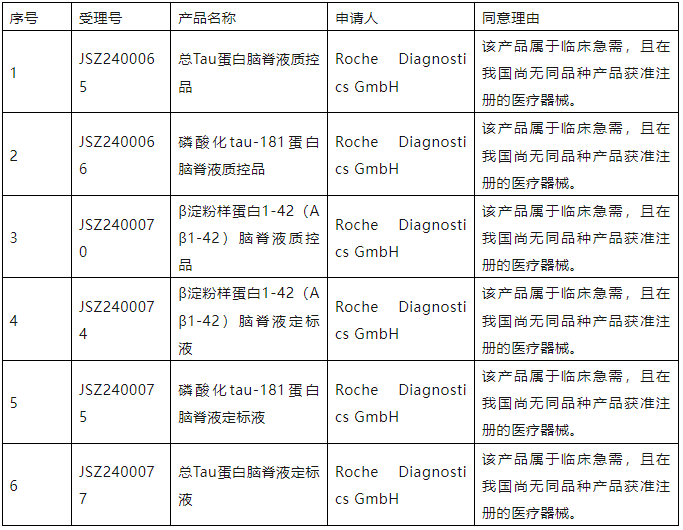
公示期內(nèi),任何單位和個人如有異議,可填寫醫(yī)療器械優(yōu)先審批項(xiàng)目異議表,提交至我中心電子郵箱:gcdivision@cmde.org.cn。
國家藥品監(jiān)督管理局
醫(yī)療器械技術(shù)審評中心
2025年1月21日
來源:器審中心

站點(diǎn)聲明
本網(wǎng)站所提供的信息僅供參考之用,并不代表本網(wǎng)贊同其觀點(diǎn),也不代表本網(wǎng)對其真實(shí)性負(fù)責(zé)。圖片版權(quán)歸原作者所有,如有侵權(quán)請聯(lián)系我們,我們立刻刪除。如有關(guān)于作品內(nèi)容、版權(quán)或其它問題請于作品發(fā)表后的30日內(nèi)與本站聯(lián)系,本網(wǎng)將迅速給您回應(yīng)并做相關(guān)處理。
鄭州思途醫(yī)療科技有限公司專注于醫(yī)療器械產(chǎn)品政策與法規(guī)規(guī)事務(wù)服務(wù),提供產(chǎn)品注冊備案申報代理、臨床試驗(yàn)、體系建立輔導(dǎo)、分類界定、申請創(chuàng)新辦理服務(wù)。

審評時間 工作程序 審評工作程序 行政審批備案工作程序 項(xiàng)目管理人員公示信息 一、化藥及生物制品 二、中藥 審評業(yè)務(wù)聯(lián)系郵箱 在審化藥新藥注冊申請相關(guān)問題:huayaoxinyao@cde.org.c

為進(jìn)一步規(guī)范體外診斷試劑的管理,國家藥監(jiān)局器審中心組織制定了《人類SDC2基因甲基化檢測試劑臨床試驗(yàn)資料技術(shù)審評要點(diǎn)》、《異常凝血酶原測定試劑臨床試驗(yàn)資料技術(shù)審評要點(diǎn)》
為落實(shí)《醫(yī)療器械監(jiān)督管理?xiàng)l例》(國務(wù)院令第739號)要求,根據(jù)《醫(yī)療器械注冊與備案管理辦法》(市場監(jiān)管總局令第47號)《體外診斷試劑注冊與備案管理辦法》(市場監(jiān)管總局令第48號),

國家藥監(jiān)局器審中心關(guān)于發(fā)布定性檢測體外診斷試劑分析性能評估等6項(xiàng)醫(yī)療器械產(chǎn)品注冊審查指導(dǎo)原則的通告(2022年第36號) 發(fā)布時間:2022-09-28 為進(jìn)一步規(guī)范定性檢測體外診斷試劑分析
為貫徹落實(shí)省委省政府關(guān)于鼓勵支持醫(yī)療器械研究與創(chuàng)新的決策部署,加快創(chuàng)新醫(yī)療器械上市審批,促進(jìn)新技術(shù)的推廣和應(yīng)用,推動醫(yī)療器械產(chǎn)業(yè)高質(zhì)量發(fā)展,江蘇省藥品監(jiān)督管理局決
思途給大家提供免于醫(yī)療器械注冊質(zhì)量管理體系核查相關(guān)說明的全文內(nèi)容和文檔下載,如果您有免于醫(yī)療器械注冊質(zhì)量管理體系核查相關(guān)說明的相關(guān)臨床需求請及時找思途,關(guān)注思途了
《創(chuàng)新醫(yī)療器械特別審查程序》解讀 一、關(guān)于創(chuàng)新醫(yī)療器械特別審查程序中有關(guān)專利方面的要求 創(chuàng)新醫(yī)療器械的審查條件之一就是申請人在中國依法擁有產(chǎn)品核心技術(shù)發(fā)明專利權(quán)。考
為落實(shí)《醫(yī)療器械監(jiān)督管理?xiàng)l例》(國務(wù)院令第739號)要求,根據(jù)《醫(yī)療器械注冊與備案管理辦法》(市場監(jiān)管總局令第47號)和《體外診斷試劑注冊與備案管理辦法》(市場監(jiān)管總局令第48號
為貫徹落實(shí)《河南省人民政府推進(jìn)政府職能轉(zhuǎn)變和“放管服”改革協(xié)調(diào)小組辦公室〈關(guān)于做好相關(guān)問題整改進(jìn)一步完提升網(wǎng)上政務(wù)服務(wù)能力的通知〉(豫“放管服”組辦〔2019〕7號)》文件

為有效預(yù)防、及時控制和消除突發(fā)公共衛(wèi)生事件的危害,確保突發(fā)公共衛(wèi)生事件應(yīng)急所需醫(yī)療器械盡快完成審批并上市使用,根據(jù)《醫(yī)療器械監(jiān)督管理?xiàng)l例》《醫(yī)療器械注冊管理辦法》
行業(yè)資訊
知識分享
法規(guī)文件
?
?
?
?
?
?
八年
醫(yī)療器械服務(wù)經(jīng)驗(yàn)
聯(lián)系思途,免費(fèi)獲得專屬《落地解決方案》及報價
咨詢相關(guān)問題或咨詢報價,可以直接與我們聯(lián)系
思途CRO——醫(yī)療器械注冊臨床第三方平臺
