臨床試驗(yàn)中的單盲、雙盲、三盲、破盲是什么意思?
盲法試驗(yàn)常用的有兩種:?jiǎn)蚊ぃ╯ingle blinding)和雙盲(double blinding),更嚴(yán)格的對(duì)照試驗(yàn)要用到三盲(triple blinding),在對(duì)照藥物和試驗(yàn)藥物劑型或外觀(guān)不同時(shí),還要用到雙盲雙模擬技


注冊(cè)備案 · 臨床試驗(yàn) · 體系建立輔導(dǎo) · 分類(lèi)界定 · 申請(qǐng)創(chuàng)新
來(lái)源:醫(yī)療器械注冊(cè)代辦 發(fā)布日期:2025-02-06 閱讀量:次
在醫(yī)療器械注冊(cè)過(guò)程中,缺乏臨床試驗(yàn)數(shù)據(jù)往往被視為一大挑戰(zhàn)。然而,通過(guò)合理利用同品種比對(duì)、探索豁免條件以及借助專(zhuān)業(yè)代辦機(jī)構(gòu)的數(shù)據(jù)整合能力,即使沒(méi)有直接的臨床試驗(yàn)結(jié)果,也能實(shí)現(xiàn)醫(yī)療器械的成功注冊(cè)。本文將詳細(xì)解析這些替代路徑,并探討如何有效利用現(xiàn)有資源以滿(mǎn)足監(jiān)管要求。

當(dāng)面臨缺乏臨床試驗(yàn)數(shù)據(jù)的情況時(shí),一種可行的方法是進(jìn)行同品種比對(duì)。這種方法適用于那些與市場(chǎng)上已有的同類(lèi)產(chǎn)品具有高度相似性的新型醫(yī)療器械。通過(guò)詳細(xì)的分析和比較,可以證明新產(chǎn)品的安全性和有效性。具體操作包括但不限于對(duì)產(chǎn)品的設(shè)計(jì)原理、技術(shù)參數(shù)、生產(chǎn)工藝等方面的全面評(píng)估。關(guān)鍵在于找到一個(gè)或多個(gè)合適的參照產(chǎn)品,并確保對(duì)比過(guò)程中所使用的數(shù)據(jù)準(zhǔn)確可靠。此外,還需撰寫(xiě)詳盡的技術(shù)文檔,清晰地闡述兩者之間的相似性及差異點(diǎn),為審查人員提供充分依據(jù)。
并非所有醫(yī)療器械都需要進(jìn)行完整的臨床試驗(yàn)才能獲得注冊(cè)。根據(jù)《醫(yī)療器械監(jiān)督管理?xiàng)l例》及相關(guān)實(shí)施細(xì)則,部分產(chǎn)品可能符合豁免條件。例如,某些低風(fēng)險(xiǎn)的第一類(lèi)醫(yī)療器械,或是已經(jīng)廣泛應(yīng)用于市場(chǎng)且有大量公開(kāi)文獻(xiàn)支持其安全性和有效性的第二類(lèi)醫(yī)療器械,有可能被豁免臨床試驗(yàn)要求。企業(yè)應(yīng)仔細(xì)研究相關(guān)法規(guī),確定自身產(chǎn)品是否屬于可豁免范圍。如果符合條件,則需準(zhǔn)備相應(yīng)的申請(qǐng)材料,向國(guó)家藥品監(jiān)督管理局(NMPA)提出豁免請(qǐng)求,并附上必要的支持性文件。
對(duì)于許多企業(yè)來(lái)說(shuō),尤其是中小企業(yè),自行處理復(fù)雜的注冊(cè)流程可能會(huì)感到力不從心。此時(shí),選擇一家經(jīng)驗(yàn)豐富的醫(yī)療器械注冊(cè)證代辦機(jī)構(gòu)成為明智之舉。這類(lèi)機(jī)構(gòu)通常具備強(qiáng)大的數(shù)據(jù)整合能力和深厚的行業(yè)知識(shí),能夠幫助企業(yè)收集、整理和優(yōu)化所需的各種資料。特別是在缺乏臨床試驗(yàn)數(shù)據(jù)的情況下,代理機(jī)構(gòu)可以通過(guò)深入挖掘現(xiàn)有資源,如學(xué)術(shù)論文、專(zhuān)利信息等,構(gòu)建有力的支持體系。同時(shí),他們還能協(xié)助制定合理的申報(bào)策略,提高注冊(cè)成功的幾率。
無(wú)論是采用同品種比對(duì)還是尋求豁免條件,制定一套全面而細(xì)致的申報(bào)策略都是成功的關(guān)鍵。這不僅涉及到前期準(zhǔn)備工作,如資料搜集和技術(shù)文檔編寫(xiě),還包括在整個(gè)注冊(cè)過(guò)程中的動(dòng)態(tài)調(diào)整。企業(yè)需要密切關(guān)注政策變化,及時(shí)更新申報(bào)內(nèi)容,確保始終符合最新的監(jiān)管要求。與此同時(shí),保持與NMPA的良好溝通也非常重要,以便于隨時(shí)了解審核進(jìn)度,并迅速響應(yīng)可能出現(xiàn)的問(wèn)題。

站點(diǎn)聲明
本網(wǎng)站所提供的信息僅供參考之用,并不代表本網(wǎng)贊同其觀(guān)點(diǎn),也不代表本網(wǎng)對(duì)其真實(shí)性負(fù)責(zé)。圖片版權(quán)歸原作者所有,如有侵權(quán)請(qǐng)聯(lián)系我們,我們立刻刪除。如有關(guān)于作品內(nèi)容、版權(quán)或其它問(wèn)題請(qǐng)于作品發(fā)表后的30日內(nèi)與本站聯(lián)系,本網(wǎng)將迅速給您回應(yīng)并做相關(guān)處理。
鄭州思途醫(yī)療科技有限公司專(zhuān)注于醫(yī)療器械產(chǎn)品政策與法規(guī)規(guī)事務(wù)服務(wù),提供產(chǎn)品注冊(cè)備案申報(bào)代理、臨床試驗(yàn)、體系建立輔導(dǎo)、分類(lèi)界定、申請(qǐng)創(chuàng)新辦理服務(wù)。

盲法試驗(yàn)常用的有兩種:?jiǎn)蚊ぃ╯ingle blinding)和雙盲(double blinding),更嚴(yán)格的對(duì)照試驗(yàn)要用到三盲(triple blinding),在對(duì)照藥物和試驗(yàn)藥物劑型或外觀(guān)不同時(shí),還要用到雙盲雙模擬技

剛接觸CRO行業(yè)的小伙伴,在學(xué)習(xí)文件法規(guī)資料的同時(shí),常看到一些英文類(lèi)專(zhuān)業(yè)名詞不知道是什么意思。下面,一起看看常見(jiàn)的臨床試驗(yàn)專(zhuān)業(yè)術(shù)語(yǔ): CRO行業(yè)的常用術(shù)語(yǔ)解釋?zhuān)?1:新藥研發(fā)

SSU是Study Start Up的縮寫(xiě),從最初的項(xiàng)目準(zhǔn)備,到啟動(dòng)訪(fǎng)視(Site Initiation Visit)之前所有的準(zhǔn)備工作,對(duì)整個(gè)臨床研究項(xiàng)目的啟動(dòng)非常關(guān)鍵。負(fù)責(zé)這個(gè)關(guān)鍵階段工作的部門(mén)人員,就叫做SS
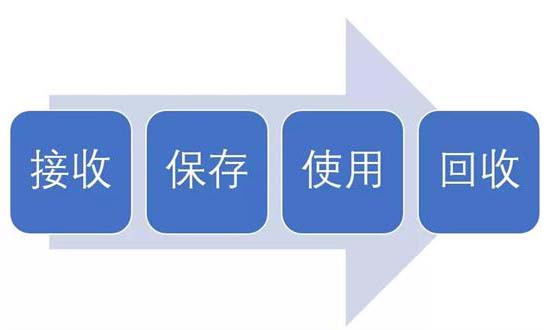
試驗(yàn)用藥品是指用于臨床試驗(yàn)的試驗(yàn)藥物、對(duì)照藥品。試驗(yàn)用藥品滲透到了臨床試驗(yàn)過(guò)程中的每一個(gè)步驟,包括藥物的生產(chǎn)、包裝、運(yùn)輸、保存、使用、回收等。今天我們從臨床試驗(yàn)中

從事醫(yī)療器械注冊(cè)的小伙伴們可能都為同一個(gè)問(wèn)題苦惱過(guò),那就是醫(yī)療器械注冊(cè)單元的劃分。企業(yè)所設(shè)計(jì)開(kāi)發(fā)出的產(chǎn)品,其所包含的產(chǎn)品范圍,是否可通過(guò)一個(gè)注冊(cè)單元完成注冊(cè),從而

不少二三類(lèi)需要臨床的產(chǎn)品,客戶(hù)一聽(tīng)到臨床報(bào)價(jià)就退縮。既然這么貴,還不如自己做......事實(shí)真的是這樣嗎?臨床報(bào)價(jià)費(fèi)用都由哪些組成?費(fèi)用都誰(shuí)收走了?自己做又有哪些風(fēng)險(xiǎn)?文

醫(yī)學(xué)的進(jìn)步是以研究為基礎(chǔ)的,這些研究在一定程度上賴(lài)于以人作為受試者的試驗(yàn)。--《赫爾辛基宣言》。Ⅰ期臨床研究目的是確定可用于臨床新藥的安全有效劑量與合理給藥方案。根據(jù)
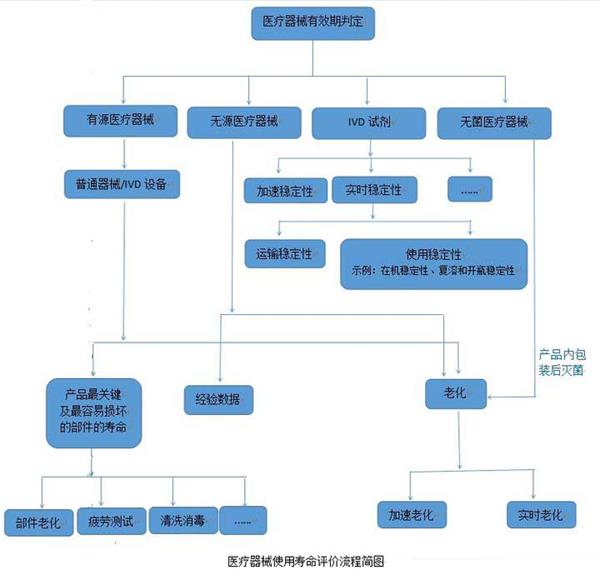
醫(yī)療器械的使用壽命是指醫(yī)療器械從規(guī)劃、設(shè)計(jì)、生產(chǎn)、銷(xiāo)售、安裝調(diào)試到使用、維修、維護(hù)檢測(cè)、報(bào)廢的全過(guò)程。而醫(yī)院使用的醫(yī)療器械的應(yīng)用質(zhì)量和安全管理在整個(gè)壽命過(guò)程中占重

俗話(huà)說(shuō)“知己知彼,百戰(zhàn)不殆”,對(duì)于作為CRC的我們,自認(rèn)為對(duì)CRA其實(shí)已經(jīng)很了解了,但是在我們工作過(guò)程有一個(gè)角色平時(shí)接觸不到,但是卻又繞不開(kāi)躲不過(guò),尤其是面對(duì)滿(mǎn)屏EDC query的

大多數(shù)CRO公司在臨床試驗(yàn)現(xiàn)場(chǎng)啟動(dòng)會(huì)(SIV)上,常由CRA主導(dǎo)。作為一名有上進(jìn)心的CRA必須清楚的了解到臨床試驗(yàn)現(xiàn)場(chǎng)啟動(dòng)考察的流程,再分享一些本人在啟動(dòng)會(huì)考察的細(xì)節(jié),請(qǐng)看下文。
行業(yè)資訊
?
?
?
?
?
?
知識(shí)分享
?
?
?
?
?
?
法規(guī)文件
?
?
?
?
?
?
八年
醫(yī)療器械服務(wù)經(jīng)驗(yàn)
聯(lián)系思途,免費(fèi)獲得專(zhuān)屬《落地解決方案》及報(bào)價(jià)
咨詢(xún)相關(guān)問(wèn)題或咨詢(xún)報(bào)價(jià),可以直接與我們聯(lián)系
思途CRO——醫(yī)療器械注冊(cè)臨床第三方平臺(tái)
