醫(yī)用口罩出口歐盟的CE(MDR)注冊流程圖
分享一下公司國外認證部門的醫(yī)用口罩CE辦理的流程和要求圖,幫助大家正確了解醫(yī)用口罩的CE注冊路徑和要求。感謝很多跟我一樣傳播正能量的同行,一起努力幫助大家正確認識CE注冊流程。


注冊備案 · 臨床試驗 · 體系建立輔導(dǎo) · 分類界定 · 申請創(chuàng)新
來源:醫(yī)療器械注冊代辦 發(fā)布日期:2019-03-17 閱讀量:次

英國政府發(fā)布了符合性標(biāo)志標(biāo)簽的指引。以下是對官方信息的匯總表:
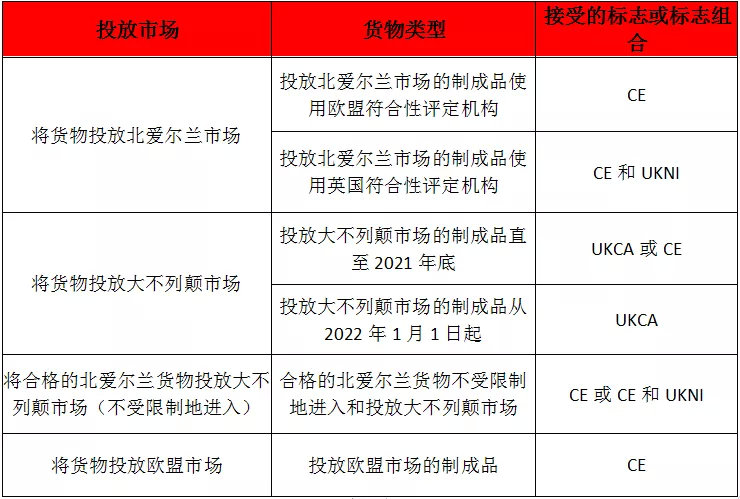
UKCA標(biāo)志是產(chǎn)品進入英國市場所必需的產(chǎn)品認證標(biāo)志,它適用于目前大多數(shù)屬于CE認證的商品。自2021年1月1日起,產(chǎn)品需滿足的技術(shù)和、標(biāo)準(zhǔn)及認證過程與當(dāng)前基本相同。原則上,UKCA標(biāo)志自2021年1月1日開始使用,但為給企業(yè)留出足夠時間適應(yīng)新標(biāo)準(zhǔn),大多數(shù)情況下,在2022年1月1日前仍可使用CE標(biāo)志。
2021年1月1日以后,如果您的產(chǎn)品符合以下所有條件,將需要立即使用新的UKCA標(biāo)志。

(1)在英國銷售的;
(2)法律法規(guī)規(guī)定須有UKCA標(biāo)志的;
(3)需要強制性的第三方合格評定的;
(4)英國合格評定機構(gòu)已進行合格評定的,但在2021年1月1日之前未將合格評定文件從英國合格評定機構(gòu)轉(zhuǎn)移到歐盟認可的機構(gòu)。
(1)UKCA標(biāo)志的高度應(yīng)至少為5 mm。對UKCA標(biāo)志進行縮小或放大時,標(biāo)志的比例需保持不變;
(2)UKCA標(biāo)志應(yīng)清晰可見和易讀(從2023年1月1日起,標(biāo)志需永久附著);
(3)當(dāng)產(chǎn)品帶有UKCA標(biāo)志時,應(yīng)出具英國符合性聲明。應(yīng)編制技術(shù)文件并保存10年。請注意:技術(shù)文檔應(yīng)證明產(chǎn)品符合法規(guī)要求;
(4)歐盟法規(guī)或指令中目前使用的某些特定術(shù)語將在英國法規(guī)中被更改。
(1)UKCA標(biāo)志可以使用于產(chǎn)品的標(biāo)簽或隨附文檔上,而不是相應(yīng)法規(guī)所要求的位置,直至2022 年12月31日(具體使用規(guī)則取決于該產(chǎn)品適用的具體法規(guī));
(2)對于進口自歐洲經(jīng)濟區(qū)(EEA)國家而投放英國市場的產(chǎn)品,關(guān)于進口商名稱和地址的標(biāo)簽豁免將延長至2022年1月31日。
根據(jù)《退出協(xié)議》中的《愛爾蘭/北愛爾蘭議定書》,某些歐盟法規(guī)中有關(guān)玩具、個人防護裝備和RoHS等消費品的規(guī)定將適用于北愛爾蘭。因此,在北愛爾蘭使用的符合性標(biāo)志(即CE標(biāo)志)將不同于在大不列顛(英格蘭、威爾士和蘇格蘭)使用的符合性標(biāo)志(即UKCA標(biāo)志)。
根據(jù)新法規(guī),對于投放北愛爾蘭市場的產(chǎn)品,如果其CE標(biāo)志的使用是基于由英國公告機構(gòu)進行的評定或基于由英國公告機構(gòu)出具的證書,則需同時使用UK(NI)標(biāo)志。
UK(NI)標(biāo)志為如下所示。除其他法規(guī)另有規(guī)定外,標(biāo)志的高度應(yīng)至少為5 mm。此標(biāo)志可被縮小或放大,但比例需保持不變。

簡而言之,在將法規(guī)規(guī)定需使用符合性標(biāo)志的產(chǎn)品投放北愛爾蘭市場時:
(1)如果使用了英國符合性評定機構(gòu),則需同時使用CE標(biāo)志和UK(NI)標(biāo)志;
(2)如果使用了歐盟符合性評定機構(gòu),則僅需使用CE標(biāo)志。
只有被歸類為“合格的北愛爾蘭貨物”并標(biāo)有上述合適的符合性標(biāo)志的產(chǎn)品,才可以投放大不列顛市場。
“合格的北愛爾蘭貨物”是指以下貨物:
(1)出現(xiàn)在北愛爾蘭,且沒有被海關(guān)監(jiān)管、限制或管控,而這些海關(guān)監(jiān)管、限制或管控并非是由于將貨物從北愛爾蘭或歐盟的領(lǐng)土中帶出而產(chǎn)生的;或
(2)北愛爾蘭加工產(chǎn)品。
詳情可參閱法規(guī)SI 2020 No.1454《合格的北愛爾蘭貨物的定義(退出歐盟)法規(guī)2020》。

站點聲明
本網(wǎng)站所提供的信息僅供參考之用,并不代表本網(wǎng)贊同其觀點,也不代表本網(wǎng)對其真實性負責(zé)。圖片版權(quán)歸原作者所有,如有侵權(quán)請聯(lián)系我們,我們立刻刪除。如有關(guān)于作品內(nèi)容、版權(quán)或其它問題請于作品發(fā)表后的30日內(nèi)與本站聯(lián)系,本網(wǎng)將迅速給您回應(yīng)并做相關(guān)處理。
鄭州思途醫(yī)療科技有限公司專注于醫(yī)療器械產(chǎn)品政策與法規(guī)規(guī)事務(wù)服務(wù),提供產(chǎn)品注冊備案申報代理、臨床試驗、體系建立輔導(dǎo)、分類界定、申請創(chuàng)新辦理服務(wù)。
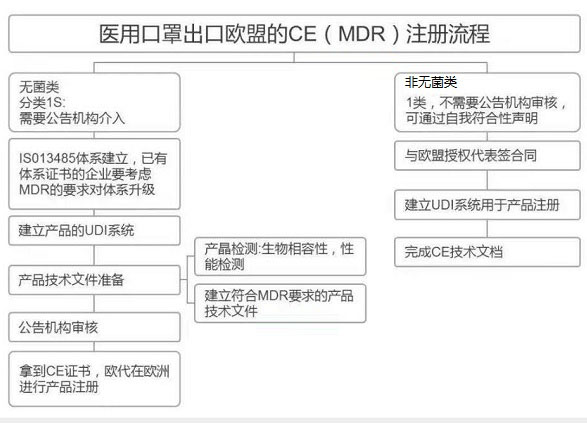
分享一下公司國外認證部門的醫(yī)用口罩CE辦理的流程和要求圖,幫助大家正確了解醫(yī)用口罩的CE注冊路徑和要求。感謝很多跟我一樣傳播正能量的同行,一起努力幫助大家正確認識CE注冊流程。

以下對歐代、英代簡單介紹,下期將針對歐洲注冊、英國注冊的要求推出詳細的專題講解,包括符合性聲明、標(biāo)簽、文件等。"

在鶴壁辦理一張醫(yī)療器械經(jīng)營許可證要多少錢?只要有人員有場地滿足辦理的要求,就可以自行辦理。自行辦理是免費的哦!本文為大家科普一下找代辦機構(gòu)辦理的情況下,鶴壁醫(yī)療器械經(jīng)營許
目前,涉及預(yù)灌封注射器相容性研究的指導(dǎo)原則包括化學(xué)藥品注射劑與塑料包裝材料相容性研究技術(shù)指導(dǎo)原則、化學(xué)藥品注射劑與藥用玻璃包裝容器相容性研究技術(shù)指導(dǎo)原則與化學(xué)藥品

在臨床過程中,異常值指檢測值超出了實驗室的正常值范圍。 有臨床意義(clinical significanCE,CS) 指檢查數(shù)值和正常標(biāo)準(zhǔn)值有差異,對臨床疾病的診斷具有一定的參考價值,而 無臨床

UKCA是英國合格認定(UK Conformity Assessed)的簡稱。2019年2月2日,英國政府公布了在無協(xié)議脫歐的情況下將會采用的UKCA標(biāo)識方案。這就意味著3月29日之后,對英國的貿(mào)易將根據(jù)世界貿(mào)易組

行業(yè)概況,眼科醫(yī)療器械指的是用于診斷、預(yù)防、治療眼部疾病或矯正視力的設(shè)備、器具、材料以及其他類似或相關(guān)物品,其主要運用于眼外科和視力保健兩大眼科領(lǐng)域。"

分子檢測市場概覽 分子檢測是一種使用DNA及/或RNA檢測技術(shù)對組成細胞及體液進行研究以鑒定分子層面的特征及異常的實驗室研究方法。分子檢測廣泛用于各類行業(yè)。除實驗室應(yīng)用外,

9月10日,中國機構(gòu)編制網(wǎng)發(fā)布了國家藥監(jiān)局、衛(wèi)健委、市場監(jiān)管總局的三定方案。三部門的職責(zé)進一步細化,職能分工更加明確。就藥監(jiān)局來說,國家局管研制、省局管生產(chǎn)、市縣管經(jīng)
行業(yè)資訊
?
?
?
?
?
?
知識分享
法規(guī)文件
?
?
?
?
?
?
八年
醫(yī)療器械服務(wù)經(jīng)驗
聯(lián)系思途,免費獲得專屬《落地解決方案》及報價
咨詢相關(guān)問題或咨詢報價,可以直接與我們聯(lián)系
思途CRO——醫(yī)療器械注冊臨床第三方平臺
