臨床倫理委員會的人員組成和工作流程圖
之前關于倫理委員會的文章中,我們提到了區(qū)域倫理委員會、倫理委員會常見問題、倫理委員會的職責和要求、倫理委員會標準操作規(guī)程及常用表格,唯獨缺了倫理委員會的人員組成和


注冊備案 · 臨床試驗 · 體系建立輔導 · 分類界定 · 申請創(chuàng)新
來源:醫(yī)療器械注冊代辦 發(fā)布日期:2024-09-27 閱讀量:次
在醫(yī)療和科研領域,倫理委員會(Ethics Committee, EC)是確保臨床試驗和研究項目符合倫理標準的重要機構(gòu)。倫理委員會秘書作為委員會的核心成員之一,承擔著多項重要職責,確保委員會的各項工作高效、有序地進行。本文將詳細探討倫理委員會秘書的具體崗位職責,包括受理審查申請、安排審查會議、匯總委員評審意見和結(jié)果、跟蹤審查、管理倫理檔案等日常事務性的工作。

倫理委員會秘書的首要職責是受理審查申請。研究者和申辦者在提交臨床試驗或研究項目的申請時,需要提供一系列必要的資料,包括試驗方案、知情同意書、研究背景資料、藥檢報告等。倫理委員會秘書負責接收這些申請材料,并進行初步審核,確保提交的資料齊全、格式規(guī)范。對于資料不全或不符合要求的申請,秘書應及時通知申請人補充或修改。秘書還需對申請材料進行登記和歸檔,確保每一份申請都有跡可循。
倫理委員會秘書負責安排審查會議,確保委員會能夠及時對提交的申請進行審議。這包括以下幾個方面:
(1)確定會議時間:根據(jù)申請的數(shù)量和緊急程度,合理安排會議時間,確保每個申請都能得到及時審查。
(2)發(fā)送會議通知:提前向所有委員發(fā)送會議通知,包括會議時間、地點、議程和需要審議的申請材料。確保委員們有足夠的時間準備和熟悉材料。
(3)準備會議資料:整理和準備會議所需的全部資料,包括申請材料、相關法規(guī)和指南等,確保會議順利進行。
在審查會議中,倫理委員會秘書負責記錄委員們的討論和評審意見。這包括:
(1)記錄會議討論:詳細記錄每位委員的發(fā)言和意見,確保所有觀點都被準確記錄。
(2)匯總評審意見:在會議結(jié)束后,匯總委員們的評審意見,形成書面記錄。這些記錄應包括委員們對申請的總體評價、具體建議和投票結(jié)果。
(3)撰寫會議紀要:根據(jù)記錄整理撰寫會議紀要,明確記錄會議的時間、地點、參會人員、討論內(nèi)容和最終決定。會議紀要應由所有參會委員簽字確認,確保其合法性和權威性。
倫理委員會秘書負責跟蹤審查結(jié)果的落實情況,確保研究項目在實施過程中符合倫理委員會的審批意見。這包括:
(1)通知申請人:將審查結(jié)果及時通知申請人,包括批準、有條件批準或拒絕的理由和建議。
(2)跟進項目進展:定期與研究者和申辦者溝通,了解項目的進展情況,確保其按照審批意見進行。對于需要修改或補充的項目,督促申請人按時提交相關材料。
(3)處理變更申請:如果研究項目在實施過程中需要進行修改或調(diào)整,秘書應受理變更申請,并安排委員進行重新審查。
倫理委員會秘書負責管理倫理檔案,確保所有文件和記錄的完整性和安全性。這包括:
(1)歸檔管理:將所有申請材料、會議記錄、評審意見、會議紀要等文件進行分類歸檔,確保每一份文件都有跡可循。
(2)電子化管理:建立電子檔案管理系統(tǒng),方便委員和相關人員查閱和管理文件。電子檔案應定期備份,確保數(shù)據(jù)安全。
(3)保密管理:確保所有文件和記錄的保密性,未經(jīng)授權不得泄露。對于敏感信息,應采取嚴格的保密措施,防止泄露。
倫理委員會秘書還應協(xié)助委員會開展培訓和宣傳活動,提升委員和相關人員的倫理意識和審查能力。這包括:
(1)組織培訓:定期組織倫理審查培訓,邀請專家進行授課,提升委員的專業(yè)知識和審查能力。
(2)宣傳倫理理念:通過內(nèi)部培訓、宣傳手冊、網(wǎng)站等多種渠道,宣傳倫理審查的重要性和基本原則,提高全院員工的倫理意識。
總之,倫理委員會秘書在倫理委員會的日常運作中發(fā)揮著重要作用。通過受理審查申請、安排審查會議、匯總委員評審意見和結(jié)果、跟蹤審查、管理倫理檔案等具體職責,秘書確保了倫理委員會工作的高效和有序。這些職責不僅有助于提升倫理審查的質(zhì)量和效率,還能夠確保研究項目的科學性和倫理性,保護受試者的權益和安全。未來,倫理委員會秘書應繼續(xù)提升自身的專業(yè)能力和管理水平,為推動醫(yī)療和科研事業(yè)的健康發(fā)展做出更大貢獻。

站點聲明
本網(wǎng)站所提供的信息僅供參考之用,并不代表本網(wǎng)贊同其觀點,也不代表本網(wǎng)對其真實性負責。圖片版權歸原作者所有,如有侵權請聯(lián)系我們,我們立刻刪除。如有關于作品內(nèi)容、版權或其它問題請于作品發(fā)表后的30日內(nèi)與本站聯(lián)系,本網(wǎng)將迅速給您回應并做相關處理。
鄭州思途醫(yī)療科技有限公司專注于醫(yī)療器械產(chǎn)品政策與法規(guī)規(guī)事務服務,提供產(chǎn)品注冊備案申報代理、臨床試驗、體系建立輔導、分類界定、申請創(chuàng)新辦理服務。

之前關于倫理委員會的文章中,我們提到了區(qū)域倫理委員會、倫理委員會常見問題、倫理委員會的職責和要求、倫理委員會標準操作規(guī)程及常用表格,唯獨缺了倫理委員會的人員組成和

倫理委員會(Ethics Committee)是由醫(yī)學專業(yè)人員、法律專家及非醫(yī)務人員組成的獨立組織,其職責為核查臨床試驗方案及附件是否合乎道德,并為之提供公眾保證,確保受試者的安全、健

臨床試驗監(jiān)查員由申辦方派出,可以是第三方委托,但不能與CRC臨床協(xié)調(diào)員出自同一公司。CRC和CRA市臨床試驗過程中不可缺貨的兩人,兩人工作上分工明確,CRC主要負責溝通協(xié)調(diào)主研、受試者、
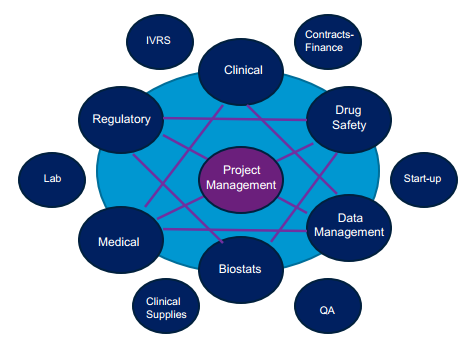
醫(yī)療器械臨床試驗在近年被大家熟知,作為醫(yī)療器械上市前重要的一環(huán),其涉及的領域非常廣泛,隨之產(chǎn)生了各種各樣的角色。CRA和DM的接觸,基本僅限于在EDC系統(tǒng)中打個照面。CRC稍多一

監(jiān)查員(MONITOR),是申辦者與研究者之間的主要聯(lián)系人,是由申辦者任命的有適當醫(yī)學、藥學或相關專業(yè)背景,并經(jīng)過必要的訓練,熟悉GCP及相關法規(guī),其任務是監(jiān)查和報告試驗的進行

藥品生產(chǎn)企中的崗位大致可分為幾個部分:研發(fā)、生產(chǎn)、市場、臨床運營部和其他部門(人力、行政、財務等)。應屆畢業(yè)生經(jīng)常會咨詢,“我以后想去藥企,想早做準備,可是藥企到

在臨床試驗中扮演著”大管家”這個角色的CRC,將越發(fā)舉足輕重。一個專業(yè)的CRC能協(xié)助研究者、申辦方有效高效地完成臨床試驗,作為一名合格的CRC,不僅要專業(yè)知識扎實,邏輯思維好

當新晉小白PM接手一個出于篩中心環(huán)節(jié)的新項目,她需要了解PM在PSV(Pre Study Visit)階段培訓資料準備及制作的職責,例如,應該怎么準備培訓資料?可以參考那些資料?我們今天來談一
2020年接近尾聲,各個公司都開始了績效核算,同時填寫個人自評表和年度發(fā)展計劃。一年的工作接近尾聲,也是時候整理收獲得失,看看距離目標的差距。上周,一位同行告訴我ta裸辭

根據(jù)《醫(yī)療器械經(jīng)營監(jiān)督管理辦法》,企業(yè)法定代表人或者負責人是醫(yī)療器械經(jīng)營質(zhì)量的主要責任人,全面負責企業(yè)日常管理。醫(yī)療器械經(jīng)營許可現(xiàn)場檢查將重點查看企業(yè)質(zhì)量負責人任
行業(yè)資訊
?
?
?
?
?
?
知識分享
八年
醫(yī)療器械服務經(jīng)驗
聯(lián)系思途,免費獲得專屬《落地解決方案》及報價
咨詢相關問題或咨詢報價,可以直接與我們聯(lián)系
思途CRO——醫(yī)療器械注冊臨床第三方平臺
