臨床試驗(yàn)中的單盲、雙盲、三盲、破盲是什么意思?
盲法試驗(yàn)常用的有兩種:?jiǎn)蚊ぃ╯ingle blinding)和雙盲(double blinding),更嚴(yán)格的對(duì)照試驗(yàn)要用到三盲(triple blinding),在對(duì)照藥物和試驗(yàn)藥物劑型或外觀不同時(shí),還要用到雙盲雙模擬技


注冊(cè)備案 · 臨床試驗(yàn) · 體系建立輔導(dǎo) · 分類界定 · 申請(qǐng)創(chuàng)新
來(lái)源:醫(yī)療器械注冊(cè)代辦 發(fā)布日期:2025-04-02 閱讀量:次
倫理審查是醫(yī)療器械臨床試驗(yàn)的第一道門檻。根據(jù)國(guó)家規(guī)定,所有涉及人體的臨床試驗(yàn)都必須經(jīng)過(guò)倫理委員會(huì)批準(zhǔn)才能開(kāi)展。倫理委員會(huì)一般由醫(yī)學(xué)專家、法律人士和社區(qū)代表組成,他們會(huì)從科學(xué)性和倫理道德兩個(gè)維度審核試驗(yàn)方案。審核重點(diǎn)包括試驗(yàn)設(shè)計(jì)的合理性、風(fēng)險(xiǎn)收益比是否可接受、受試者權(quán)益如何保障等。最近有家做心臟支架的企業(yè),就因?yàn)閭惱韺彶闆](méi)通過(guò),臨床試驗(yàn)推遲了好幾個(gè)月,損失不小。這里提醒大家,提交倫理審查材料時(shí)一定要準(zhǔn)備充分,特別是風(fēng)險(xiǎn)控制措施和應(yīng)急預(yù)案,這兩塊內(nèi)容委員會(huì)看得特別仔細(xì)。

知情同意流程是保護(hù)受試者權(quán)益的核心環(huán)節(jié)。法規(guī)要求必須確保每位受試者在完全理解試驗(yàn)內(nèi)容的前提下自愿參加。實(shí)際操作中,研究人員需要用通俗易懂的語(yǔ)言解釋試驗(yàn)?zāi)康摹⒘鞒獭⒖赡艿娘L(fēng)險(xiǎn)和獲益,還要告知受試者隨時(shí)退出的權(quán)利。現(xiàn)在很多機(jī)構(gòu)都開(kāi)始使用電子知情同意系統(tǒng),既方便存檔又提高了效率。有個(gè)做血糖儀的企業(yè)在臨床試驗(yàn)中就遇到過(guò)問(wèn)題,他們用的知情同意書(shū)專業(yè)術(shù)語(yǔ)太多,導(dǎo)致不少老年受試者沒(méi)完全理解內(nèi)容,后來(lái)被倫理委員會(huì)要求整改。建議大家在設(shè)計(jì)知情同意書(shū)時(shí),多找非專業(yè)人士試讀,確保普通人都能看懂。
醫(yī)療器械注冊(cè)過(guò)程中的臨床試驗(yàn)特別注重?cái)?shù)據(jù)真實(shí)性。監(jiān)管部門在審批時(shí),除了看試驗(yàn)結(jié)果,還會(huì)重點(diǎn)檢查倫理審查和知情同意的執(zhí)行情況。比如去年有個(gè)骨科植入物的注冊(cè)申請(qǐng)被退回來(lái),原因就是部分知情同意書(shū)簽署不規(guī)范。為了避免這類問(wèn)題,建議企業(yè)在試驗(yàn)開(kāi)始前就對(duì)研究團(tuán)隊(duì)進(jìn)行系統(tǒng)培訓(xùn),最好能請(qǐng)專業(yè)的CRO機(jī)構(gòu)如思途CRO協(xié)助把關(guān)。現(xiàn)在有些智能醫(yī)療器械企業(yè)已經(jīng)開(kāi)始嘗試用區(qū)塊鏈技術(shù)來(lái)存證知情同意過(guò)程,這種做法既符合法規(guī)要求又能提高效率,值得關(guān)注。
實(shí)際操作中經(jīng)常遇到的問(wèn)題是如何平衡科學(xué)性和倫理要求。有些創(chuàng)新醫(yī)療器械的試驗(yàn)設(shè)計(jì)可能科學(xué)上很完美,但倫理風(fēng)險(xiǎn)較高,這時(shí)候就需要調(diào)整方案。比如某款A(yù)I輔助診斷設(shè)備,最初方案要求健康受試者也接受放射性檢查,倫理委員會(huì)認(rèn)為這對(duì)健康人風(fēng)險(xiǎn)太大,后來(lái)改為只招募需要這類檢查的患者。這種情況在醫(yī)療器械臨床試驗(yàn)中很常見(jiàn),關(guān)鍵是要提前與倫理委員會(huì)充分溝通,找到各方都能接受的解決方案。
最后說(shuō)說(shuō)跨境臨床試驗(yàn)的倫理審查問(wèn)題。隨著國(guó)內(nèi)醫(yī)療器械企業(yè)走出去的越來(lái)越多,在海外開(kāi)展臨床試驗(yàn)的需求也在增長(zhǎng)。不同國(guó)家的倫理審查標(biāo)準(zhǔn)差異很大,比如歐盟要求更注重?cái)?shù)據(jù)隱私保護(hù),美國(guó)則對(duì)少數(shù)族裔的納入比例有明確規(guī)定。如果計(jì)劃開(kāi)展國(guó)際多中心臨床試驗(yàn),建議提前了解目標(biāo)國(guó)家的具體要求,必要時(shí)可以尋求專業(yè)CRO機(jī)構(gòu)的支持。思途醫(yī)療科技在這方面就有豐富經(jīng)驗(yàn),幫助過(guò)多家國(guó)內(nèi)企業(yè)順利完成海外臨床試驗(yàn)。
總的來(lái)說(shuō),醫(yī)療器械臨床試驗(yàn)的倫理審查和知情同意看似是程序性工作,實(shí)則關(guān)系到整個(gè)試驗(yàn)的合法性和數(shù)據(jù)質(zhì)量。隨著法規(guī)越來(lái)越完善,監(jiān)管越來(lái)越嚴(yán)格,企業(yè)必須重視這兩個(gè)環(huán)節(jié)。與其事后補(bǔ)救,不如從一開(kāi)始就按最高標(biāo)準(zhǔn)來(lái)執(zhí)行,這樣既能保障受試者權(quán)益,也能為產(chǎn)品注冊(cè)打下堅(jiān)實(shí)基礎(chǔ)。

站點(diǎn)聲明
本網(wǎng)站所提供的信息僅供參考之用,并不代表本網(wǎng)贊同其觀點(diǎn),也不代表本網(wǎng)對(duì)其真實(shí)性負(fù)責(zé)。圖片版權(quán)歸原作者所有,如有侵權(quán)請(qǐng)聯(lián)系我們,我們立刻刪除。如有關(guān)于作品內(nèi)容、版權(quán)或其它問(wèn)題請(qǐng)于作品發(fā)表后的30日內(nèi)與本站聯(lián)系,本網(wǎng)將迅速給您回應(yīng)并做相關(guān)處理。
鄭州思途醫(yī)療科技有限公司專注于醫(yī)療器械產(chǎn)品政策與法規(guī)規(guī)事務(wù)服務(wù),提供產(chǎn)品注冊(cè)備案申報(bào)代理、臨床試驗(yàn)、體系建立輔導(dǎo)、分類界定、申請(qǐng)創(chuàng)新辦理服務(wù)。

盲法試驗(yàn)常用的有兩種:?jiǎn)蚊ぃ╯ingle blinding)和雙盲(double blinding),更嚴(yán)格的對(duì)照試驗(yàn)要用到三盲(triple blinding),在對(duì)照藥物和試驗(yàn)藥物劑型或外觀不同時(shí),還要用到雙盲雙模擬技

剛接觸CRO行業(yè)的小伙伴,在學(xué)習(xí)文件法規(guī)資料的同時(shí),常看到一些英文類專業(yè)名詞不知道是什么意思。下面,一起看看常見(jiàn)的臨床試驗(yàn)專業(yè)術(shù)語(yǔ): CRO行業(yè)的常用術(shù)語(yǔ)解釋: 1:新藥研發(fā)

SSU是Study Start Up的縮寫(xiě),從最初的項(xiàng)目準(zhǔn)備,到啟動(dòng)訪視(Site Initiation Visit)之前所有的準(zhǔn)備工作,對(duì)整個(gè)臨床研究項(xiàng)目的啟動(dòng)非常關(guān)鍵。負(fù)責(zé)這個(gè)關(guān)鍵階段工作的部門人員,就叫做SS

初次申請(qǐng)消字號(hào)備案,總會(huì)遇到磕磕絆絆的問(wèn)題,常見(jiàn)的有申請(qǐng)流程、申請(qǐng)資料、申請(qǐng)周期等問(wèn)題,本文將對(duì)申請(qǐng)消字號(hào)產(chǎn)品流程及費(fèi)用簡(jiǎn)單概述,對(duì)即將進(jìn)入消毒產(chǎn)品行業(yè)的企業(yè)做一
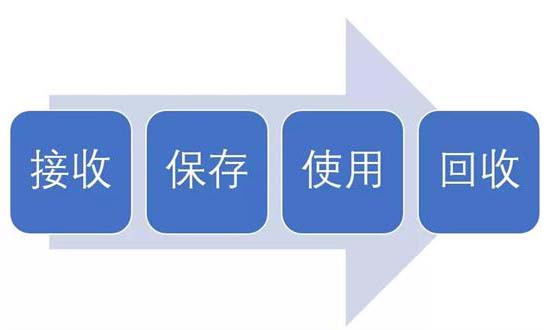
試驗(yàn)用藥品是指用于臨床試驗(yàn)的試驗(yàn)藥物、對(duì)照藥品。試驗(yàn)用藥品滲透到了臨床試驗(yàn)過(guò)程中的每一個(gè)步驟,包括藥物的生產(chǎn)、包裝、運(yùn)輸、保存、使用、回收等。今天我們從臨床試驗(yàn)中

從事醫(yī)療器械注冊(cè)的小伙伴們可能都為同一個(gè)問(wèn)題苦惱過(guò),那就是醫(yī)療器械注冊(cè)單元的劃分。企業(yè)所設(shè)計(jì)開(kāi)發(fā)出的產(chǎn)品,其所包含的產(chǎn)品范圍,是否可通過(guò)一個(gè)注冊(cè)單元完成注冊(cè),從而

不少二三類需要臨床的產(chǎn)品,客戶一聽(tīng)到臨床報(bào)價(jià)就退縮。既然這么貴,還不如自己做......事實(shí)真的是這樣嗎?臨床報(bào)價(jià)費(fèi)用都由哪些組成?費(fèi)用都誰(shuí)收走了?自己做又有哪些風(fēng)險(xiǎn)?文

醫(yī)學(xué)的進(jìn)步是以研究為基礎(chǔ)的,這些研究在一定程度上賴于以人作為受試者的試驗(yàn)。--《赫爾辛基宣言》。Ⅰ期臨床研究目的是確定可用于臨床新藥的安全有效劑量與合理給藥方案。根據(jù)
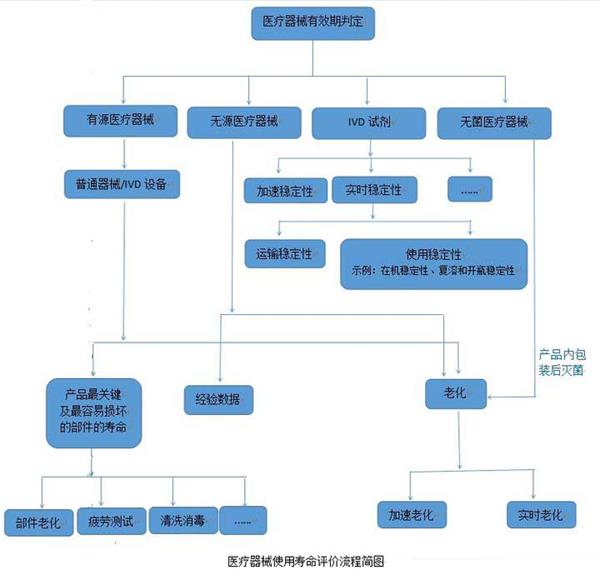
醫(yī)療器械的使用壽命是指醫(yī)療器械從規(guī)劃、設(shè)計(jì)、生產(chǎn)、銷售、安裝調(diào)試到使用、維修、維護(hù)檢測(cè)、報(bào)廢的全過(guò)程。而醫(yī)院使用的醫(yī)療器械的應(yīng)用質(zhì)量和安全管理在整個(gè)壽命過(guò)程中占重

俗話說(shuō)“知己知彼,百戰(zhàn)不殆”,對(duì)于作為CRC的我們,自認(rèn)為對(duì)CRA其實(shí)已經(jīng)很了解了,但是在我們工作過(guò)程有一個(gè)角色平時(shí)接觸不到,但是卻又繞不開(kāi)躲不過(guò),尤其是面對(duì)滿屏EDC query的
行業(yè)資訊
?
?
?
?
?
?
知識(shí)分享
?
?
?
?
?
?
法規(guī)文件
?
?
?
?
?
?
八年
醫(yī)療器械服務(wù)經(jīng)驗(yàn)
聯(lián)系思途,免費(fèi)獲得專屬《落地解決方案》及報(bào)價(jià)
咨詢相關(guān)問(wèn)題或咨詢報(bào)價(jià),可以直接與我們聯(lián)系
思途CRO——醫(yī)療器械注冊(cè)臨床第三方平臺(tái)
